FDA許可Juno繼續(xù)進行臨床試驗
今日,總部位于西雅圖的Juno Therapeutics宣布FDA批準其ROCKET臨床試驗可以繼續(xù)進行。這項2期臨床試驗旨在通過CAR-T療法,治療復發(fā)性或難治性的B細胞急性淋巴細胞白血病。
在上周的臨床試驗中,兩名患者在經(jīng)治后由于出現(xiàn)腦水腫而去世,這也一度讓FDA暫停了ROCKET試驗。“在第一例死亡病例出現(xiàn)后,我們立刻暫停了這項臨床試驗,并同F(xiàn)DA以及公司內(nèi)部的數(shù)據(jù)安全監(jiān)測委員會進行了復審。”Juno的首席執(zhí)行官Hans Bishop先生在7月7日說道。
暫停試驗之后,F(xiàn)DA要求Juno對四項材料進行修訂,其中包括患者知情同意書與試驗方案。Juno在上周宣布將于本周遞交修訂的材料。
在對臨床試驗結(jié)果進行了詳盡的分析后,Juno認為在CAR-T治療前使用的化療藥物fludarabine可能導致了臨床試驗中的不幸。“在ROCKET試驗中,往預處理的藥物里添加fludarabine會讓嚴重神經(jīng)毒性的風險上升。這也不幸在上周讓兩名患者因腦水腫去世。”Bishop先生總結(jié)說。因此,Juno提議在未來的預處理藥物中去除fludarabine,以避免再出現(xiàn)同樣的問題。
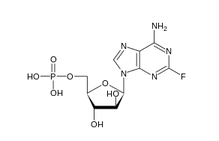
▲可能導致這兩場不幸的fludarabine
FDA對Juno的提供的報告表示認可。FDA先前表示對Juno材料的審查最多需要30天的時間,而在美國當?shù)貢r間周二,F(xiàn)DA就將材料審閱完畢,并同意恢復ROCKET試驗。在接下來的試驗中,患者接受的預處理藥物將只包括cyclophosphamide(另一種化療藥物)。Juno也希望能夠通過這一改變,避免未來再出現(xiàn)患者死亡。
ROCKET試驗中的JCAR015是Juno的領(lǐng)先產(chǎn)品,原本有望在2017年進入市場,但上周的意外將它的上市計劃無限推遲。在這次FDA的快速批準下,JCAR015或能繼續(xù)保持原有的上市計劃。我們將在下個月得知更多有關(guān)JCAR015的信息。
新藥研發(fā)的過程從來不是坦途,這一路上注定會有荊棘與陰霾。我們祝愿Juno的這項CAR-T療法在接下來的臨床試驗中能夠取得成功,并能最終上市造福更多的患者。這是對那些為人類健康做出犧牲的志愿者最好的銘記。

分享到:








 相關(guān)新聞
相關(guān)新聞