7月14日,美國(guó)食品與藥品管理局(FDA)發(fā)布了藥物和診斷共同開發(fā)需遵循準(zhǔn)則的指南草案,旨在將該指南作為實(shí)用的參考框架,幫助開發(fā)者推進(jìn)治療產(chǎn)品和伴隨診斷的開發(fā),并幫助FDA工作人員審查這些產(chǎn)品。
FDA在指南草案中寫到,“IVD伴隨診斷和治療產(chǎn)品的共同開發(fā)對(duì)于精準(zhǔn)醫(yī)療的推進(jìn)至關(guān)重要。FDA試圖通過(guò)向開發(fā)者提供一套準(zhǔn)則,幫助他們進(jìn)行有效的共同開發(fā)以及執(zhí)行FDA的監(jiān)管要求,進(jìn)而加速精準(zhǔn)醫(yī)療方面的創(chuàng)新。”
Rx/Dx共同開發(fā)方案的監(jiān)管
對(duì)FDA來(lái)說(shuō),理想的Rx/Dx共同開發(fā)方案是,在藥物研發(fā)的最早期確定需要開發(fā)的伴隨診斷,兩者同時(shí)開發(fā)并同時(shí)進(jìn)入市場(chǎng)。
兩年前FDA發(fā)布伴隨診斷的指南時(shí)闡述了上述理想方案。但后來(lái)FDA意識(shí)到,對(duì)藥物和伴隨診斷同時(shí)進(jìn)行評(píng)估并不總是可行,因此允許將伴隨診斷的評(píng)估時(shí)間推后,先確定藥物是否對(duì)某種無(wú)藥可用的威脅生命的疾病有效。
通常情況下,F(xiàn)DA認(rèn)為伴隨診斷屬于ClassIII、高風(fēng)險(xiǎn)產(chǎn)品,需要售前批準(zhǔn)。但在共同開發(fā)指南中,F(xiàn)DA認(rèn)為,一些Rx/Dx共同開發(fā)產(chǎn)品中的伴隨診斷可歸類為ClassII、中度風(fēng)險(xiǎn)產(chǎn)品,得到510(k)許可或de novo request后即可進(jìn)入市場(chǎng)。
藥物和檢測(cè)開發(fā)的推進(jìn)過(guò)程是明顯不同的,該指南提供了一個(gè)圖表,告訴開發(fā)者如何調(diào)整計(jì)劃以及何時(shí)應(yīng)該向FDA尋求意見。FDA建議,開發(fā)者需對(duì)治療和診斷的研發(fā)都有一定的了解,并且治療和診斷研發(fā)雙方都要出席與FDA藥物和診斷部門的會(huì)議。
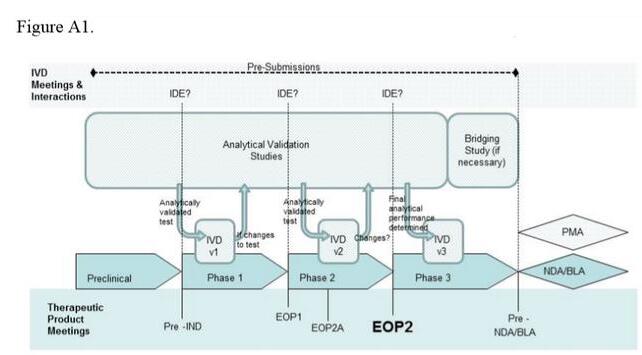
FDA對(duì)伴隨診斷的定義是,一種必需的驗(yàn)證藥物安全性和有效性的檢測(cè)。因此,F(xiàn)DA建議,伴隨診斷(CDx)的性能分析需在它應(yīng)用在藥物的臨床試驗(yàn)前進(jìn)行。當(dāng)沒有足夠的數(shù)據(jù)證明一種試驗(yàn)性新藥對(duì)患者的風(fēng)險(xiǎn)時(shí),F(xiàn)DA會(huì)對(duì)這項(xiàng)研究下達(dá)“clinical hold(臨床試驗(yàn)暫停)”通知。但FDA表示,伴隨診斷性能分析的不確定性不會(huì)導(dǎo)致這種暫停。
如果一種藥物的伴隨診斷之前未得到FDA批準(zhǔn)用于這種特定用途,開發(fā)者必須提出申請(qǐng)并獲得器械臨床研究豁免(IDE)。在該指南草案中,F(xiàn)DA概述了IDE申請(qǐng)應(yīng)該包含的信息類型,以及在什么情況下體外診斷(IVD)可以不需要這個(gè)過(guò)程。該指南還討論了檢測(cè)開發(fā)者在利用訓(xùn)練樣本集、檢測(cè)設(shè)計(jì)變更的影響和IVD橋接試驗(yàn)中應(yīng)該考慮的一些因素。
樣本采集
近一段時(shí)間,F(xiàn)DA一直在告誡開發(fā)者,醫(yī)生越來(lái)越多地預(yù)篩選病人,以明確他們進(jìn)行生物標(biāo)志物臨床試驗(yàn)的資格,而這種行為會(huì)給Rx/Dx共同開發(fā)帶來(lái)問題。FDA表示,“預(yù)篩查會(huì)產(chǎn)生具有偏好性的臨床試驗(yàn)人群,這個(gè)群體不能代表真實(shí)世界中使用IVD伴隨診斷的群體。因此,F(xiàn)DA強(qiáng)烈地反對(duì)挑選測(cè)試對(duì)象。”
FDA建議,開發(fā)者應(yīng)該要求臨床試驗(yàn)參與單位提交的樣本來(lái)自于所有潛在候選檢測(cè)人群,而不是經(jīng)過(guò)本地檢測(cè)篩選出來(lái)的人群。FDA說(shuō),這樣才能夠評(píng)估IVD真實(shí)的分析能力,并且能夠確保意向治療人群不具有任何偏好性。
該指南草案還表示,F(xiàn)DA將在很多方面更加靈活,例如,允許在早期研究中使用臨床試驗(yàn)分析,可展示NGS檢測(cè)中有代表性的標(biāo)記物的分析驗(yàn)證結(jié)果,當(dāng)真實(shí)的病人樣本無(wú)法獲取時(shí)可利用人為樣本研究某種特定標(biāo)記物。
但是FDA在指南中還指出,樣本采集對(duì)一個(gè)共同開發(fā)方案的成功至關(guān)重要,鼓勵(lì)開發(fā)者從所有招募的檢測(cè)對(duì)象中獲取樣本。這樣可確保臨床試驗(yàn)分析進(jìn)行不下去的情況下,開發(fā)者仍然能夠?qū)Π殡S檢測(cè)進(jìn)行驗(yàn)證且使其商業(yè)化。
生物標(biāo)記物相關(guān)試驗(yàn)的設(shè)計(jì)
該指南指出,制藥公司可以進(jìn)行不同類型的生物標(biāo)記物試驗(yàn)設(shè)計(jì),一種設(shè)計(jì)是按照陽(yáng)性和陰性生物標(biāo)記物狀態(tài)將患者隨機(jī)分為兩組,另一種設(shè)計(jì)是僅將陽(yáng)性生物標(biāo)記物狀態(tài)的患者隨機(jī)分到治療組。
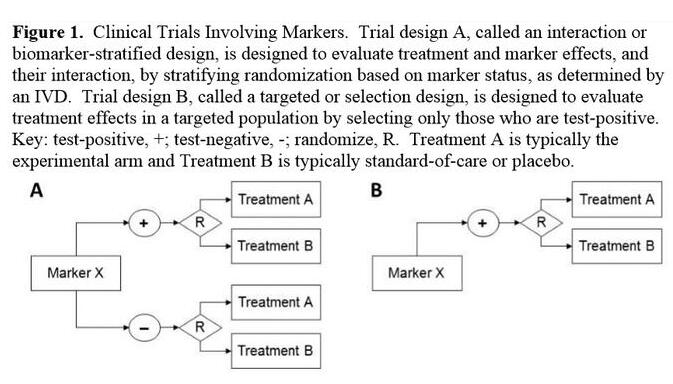
FDA表示,在衡量生物標(biāo)記物的預(yù)后和預(yù)測(cè)價(jià)值方面,第一種試驗(yàn)設(shè)計(jì)最有用。但是當(dāng)有證據(jù)表明生物標(biāo)記物陰性的患者對(duì)治療沒有應(yīng)答時(shí),F(xiàn)DA會(huì)加速對(duì)只招募陽(yáng)性生物標(biāo)記物患者的精準(zhǔn)藥物研究的審批工作。FDA還討論了一些方案,使制藥公司在一項(xiàng)前瞻性研究完成后,可以基于生物標(biāo)記物回顧性地評(píng)估病人的應(yīng)答情況。
根據(jù)伴隨診斷是如何在藥物試驗(yàn)中使用的,它將獲得一份聲明文件表明它的作用,是用于預(yù)測(cè)療效,監(jiān)測(cè)藥物劑量或者停藥,還是用于篩選進(jìn)行臨床試驗(yàn)的病人。FDA表示,“就篩選病人的伴隨診斷聲明來(lái)說(shuō),如果主要藥效試驗(yàn)表明,該藥品對(duì)IVD篩選的人群具有足夠的安全性和有效性,這就說(shuō)明該IVD得到了臨床驗(yàn)證,其選擇的群體能從該治療產(chǎn)品中獲益。”
指南草案的意見征集
1998年,F(xiàn)DA批準(zhǔn)了第一個(gè)乳腺癌治療藥物Herceptin(trastuzumab)和其伴隨診斷HercepTest。近年來(lái),Rx/Dx共同開發(fā)產(chǎn)品快速增多,尤其是腫瘤類產(chǎn)品。該指南草案中關(guān)于共同開發(fā)的建議都來(lái)自FDA多年來(lái)批準(zhǔn)這類產(chǎn)品的經(jīng)驗(yàn)。
個(gè)性化醫(yī)學(xué)聯(lián)盟(Personalized Medicine Coalition,PMC)的執(zhí)行副總裁Amy Miller說(shuō),“FDA藥品和診斷部門開發(fā)了內(nèi)部流程,使腫瘤藥物通過(guò)FDA審查。我們建議FDA利用這些經(jīng)驗(yàn),為開發(fā)者和FDA其他審查領(lǐng)域的員工起草一份“如何做”的指南,所以他們就制定了這份指南草案。”
該共同開發(fā)指南草案已經(jīng)制定了很長(zhǎng)一段時(shí)間了,多年來(lái)FDA與利益相關(guān)人士在研討會(huì)和行業(yè)會(huì)議上就文件中的相關(guān)準(zhǔn)則進(jìn)行了交流。Miller說(shuō),PMC會(huì)進(jìn)一步研究這份草案并提出改進(jìn)意見。公眾有90天時(shí)間對(duì)該指南草案提出意見。










 相關(guān)新聞
相關(guān)新聞