一致性評(píng)價(jià)核查指導(dǎo)原則四連發(fā)
核查要點(diǎn)有哪些?什么情形“不通過(guò)”?
臨床、研發(fā)和生產(chǎn)全方位合規(guī),更重視關(guān)鍵細(xì)節(jié)
12月21日,CFDA官網(wǎng)發(fā)布了《仿制藥質(zhì)量和療效一致性評(píng)價(jià)研究現(xiàn)場(chǎng)核查指導(dǎo)原則(征求意見(jiàn)稿)》《仿制藥質(zhì)量和療效一致性評(píng)價(jià)生產(chǎn)現(xiàn)場(chǎng)檢查指導(dǎo)原則(征求意見(jiàn)稿)》《仿制藥質(zhì)量和療效一致性評(píng)價(jià)臨床試驗(yàn)核查指導(dǎo)原則(征求意見(jiàn)稿)》和《仿制藥質(zhì)量和療效一致性評(píng)價(jià)有因檢查指導(dǎo)原則(征求意見(jiàn)稿)》4個(gè)指導(dǎo)原則。這4個(gè)征求意見(jiàn)稿進(jìn)一步細(xì)化仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作申報(bào)流程。
從4個(gè)征求意見(jiàn)稿的核查要點(diǎn)、判定原則等可以看出,CFDA越來(lái)越關(guān)注核查中的關(guān)鍵細(xì)節(jié)。特別是:藥品申報(bào)中提交的產(chǎn)品生產(chǎn)批次的重要數(shù)據(jù)完整性;藥品生產(chǎn)過(guò)程是否按照藥品申報(bào)資料中承諾的要求進(jìn)行生產(chǎn);用于生物利用度(或等效性)研究的產(chǎn)品批次或申報(bào)提交批次的生產(chǎn)是否遵守GMP;用于生物利用度(或等效性)研究的產(chǎn)品批次或申報(bào)提交批次的生產(chǎn)中有無(wú)進(jìn)行處方變更或工藝變更;關(guān)鍵臨床試驗(yàn)用產(chǎn)品批次與新藥申報(bào)所提交的批次之間的工藝是否存在顯著差異;公司生產(chǎn)設(shè)施是否缺乏生產(chǎn)商業(yè)批成品藥或原料藥的能力等。
仿制藥即將進(jìn)入臨床、研發(fā)和生產(chǎn)都追求真實(shí)、合規(guī)的年代。
對(duì)應(yīng)“工作程序”
這個(gè)四個(gè)原則對(duì)應(yīng)2016年5月25日CFDA組織發(fā)布的《仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作程序》(簡(jiǎn)稱“工作程序”,下同)比較如下:
研究現(xiàn)場(chǎng)核查指導(dǎo)原則和生產(chǎn)現(xiàn)場(chǎng)檢查指導(dǎo)原則對(duì)應(yīng)“工作程序”第四部分“資料的接收和受理”的研制現(xiàn)場(chǎng)核查和生產(chǎn)現(xiàn)場(chǎng)檢查,此部分內(nèi)容類似于FDA藥品申報(bào)注冊(cè)批準(zhǔn)前檢查。
臨床試驗(yàn)核查指導(dǎo)原則和有因檢查指導(dǎo)原則分別對(duì)應(yīng)工作程序第五部分“臨床試驗(yàn)數(shù)據(jù)核查”中臨床研究數(shù)據(jù)的真實(shí)性、規(guī)范性和完整性的核查,以及核查中心根據(jù)一致性評(píng)價(jià)辦公室在一致性評(píng)價(jià)技術(shù)評(píng)審過(guò)程中發(fā)現(xiàn)的問(wèn)題所開展的有因核查。
基本要求
研究現(xiàn)場(chǎng)核查指導(dǎo)原則和生產(chǎn)現(xiàn)場(chǎng)核查指導(dǎo)原則基本要求都包括真實(shí)性、一致性、數(shù)據(jù)可靠性和合規(guī)性。臨床試驗(yàn)核查指導(dǎo)原則基本要求包括確保受試者的安全與權(quán)益得到保護(hù),確保評(píng)價(jià)產(chǎn)品的一致性,確保數(shù)據(jù)的真實(shí)性、可靠性和臨床試驗(yàn)開展的合規(guī)性。
核查程序
程序方面,進(jìn)口仿制藥品無(wú)論是研究現(xiàn)場(chǎng)還是生產(chǎn)現(xiàn)場(chǎng)都有可能要面臨境外檢查,核查中心將結(jié)合境外檢查工作安排,在當(dāng)年接收的資料中選擇不低于30%的企業(yè)列入第二年的境外檢查計(jì)劃,組織研究現(xiàn)場(chǎng)核查。原則上在每五年內(nèi),對(duì)所有接收資料的企業(yè)的現(xiàn)場(chǎng)檢查覆蓋率達(dá)到100%。
有因檢查的程序比較特殊。有因檢查將會(huì)在一致性評(píng)價(jià)的評(píng)審過(guò)程中發(fā)現(xiàn)的問(wèn)題,一致性評(píng)價(jià)及其藥品注冊(cè)相關(guān)的舉報(bào)問(wèn)題,藥品監(jiān)督管理部門或一致性評(píng)價(jià)辦公室認(rèn)為需進(jìn)行核查的其他情形下啟動(dòng)。有因檢查重點(diǎn)針對(duì)發(fā)起的原因開展檢查,可以進(jìn)行必要的延伸檢查,可以不進(jìn)行全面系統(tǒng)的檢查。有因檢查可采取事前通知或不告知的方式開展,也可參照飛行檢查方式開展。必要時(shí),有因檢查將在現(xiàn)場(chǎng)抽取樣品送一致性評(píng)價(jià)辦公室指定的藥品檢驗(yàn)機(jī)構(gòu)進(jìn)行復(fù)核檢驗(yàn)。
“通過(guò)”“不通過(guò)”判定
研究現(xiàn)場(chǎng)核查指導(dǎo)原則、生產(chǎn)現(xiàn)場(chǎng)核查指導(dǎo)原則和臨床試驗(yàn)核查指導(dǎo)原則的判定結(jié)論都有“不通過(guò)”判定原則,這三大核查指導(dǎo)原則判定“不批準(zhǔn)”共性是發(fā)生真實(shí)性問(wèn)題,拒絕、不配合核查,導(dǎo)致無(wú)法繼續(xù)進(jìn)行現(xiàn)場(chǎng)核查都將得到“不通過(guò)”的判定。僅研究現(xiàn)場(chǎng)核查指導(dǎo)原則和生產(chǎn)現(xiàn)場(chǎng)核查指導(dǎo)原則有“通過(guò)”判定。臨床試驗(yàn)核查指導(dǎo)原則的判定沒(méi)有“通過(guò)”的判定,除了“不通過(guò)”判定外只有“現(xiàn)場(chǎng)檢查存在下列問(wèn)題,建議結(jié)合該品種的具體審評(píng)情況,評(píng)判對(duì)有效性和安全性指標(biāo)的影響”的評(píng)定結(jié)論。
有因檢查比較特別,一切圍繞“因”重點(diǎn)開展檢查,但有“因”檢查的“不通過(guò)”具有延續(xù)性,當(dāng)有因檢查的結(jié)論為“不通過(guò)”時(shí),對(duì)應(yīng)的檢查結(jié)論應(yīng)判定為“不通過(guò)”。

梳理<<<
一致性評(píng)價(jià)相關(guān)文件清單
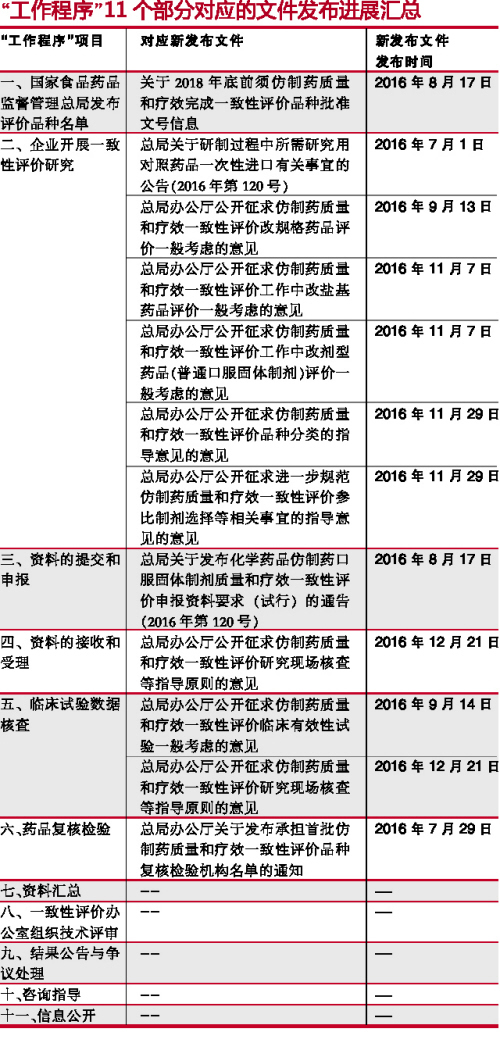
根據(jù)《仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作程序》(簡(jiǎn)稱“工作程序”),一致性評(píng)價(jià)工作可分為11個(gè)部分。2016年5月25日之后,這11個(gè)部分對(duì)應(yīng)的文件發(fā)布匯總(見(jiàn)下表)可見(jiàn),目前的文件發(fā)布針對(duì)從 “國(guó)家食品藥品監(jiān)督管理總局發(fā)布評(píng)價(jià)品種名單”(第一部分)到 “藥品復(fù)核檢驗(yàn)”(第六部分)。實(shí)際上,大部分指導(dǎo)原則已經(jīng)出臺(tái),企業(yè)應(yīng)開始有針對(duì)性地根據(jù)CFDA要求準(zhǔn)備資料。

分享到:










 相關(guān)新聞
相關(guān)新聞