首批通過一致性評價藥品獲批?
近日,CFDA在“藥品監(jiān)管動態(tài)”欄目中的《總局批準(zhǔn)吉非替尼片等3個國產(chǎn)仿制藥品上市》中,正式公布各自領(lǐng)域內(nèi)一線治療藥物抗癌藥吉非替尼片“易瑞沙”、抗艾滋病藥依非韋倫片“施多寧”以及富馬酸替諾福韋二吡呋酯片“韋瑞德”的國產(chǎn)仿制藥品被批準(zhǔn)上市。
此次批準(zhǔn)的齊魯制藥(海南)生產(chǎn)的吉非替尼片、上海迪賽諾生物生產(chǎn)的依非韋倫片以及成都倍特藥業(yè)生產(chǎn)的富馬酸替諾福韋二吡呋酯片,均與原研藥的質(zhì)量和療效基本一致。
筆者大膽推測,此批國產(chǎn)仿制藥很有可能是首批獲批一致性評價的藥品,這將為后來還在排隊的申報注冊者樹立了門檻風(fēng)向標(biāo)——沒有按照一致性評價要求,并且按舊注冊法規(guī)仿制申報生產(chǎn)仍在排隊的同類產(chǎn)品獲批難度增大。
藥品一致性評價的最終結(jié)果將改變產(chǎn)品的競爭態(tài)勢,因此備受行業(yè)關(guān)注。
按2016年5月26日關(guān)于落實《國務(wù)院辦公廳關(guān)于開展仿制藥質(zhì)量和療效一致性評價的意見》有關(guān)事項的公告(2016年第106號),“食品藥品監(jiān)管總局和中國食品藥品檢定研究院在門戶網(wǎng)站開設(shè)‘仿制藥一致性評價’信息專欄,及時發(fā)布一致性評價工作進展,公開參比制劑備案、品種申報、受理等動態(tài)信息,全面引導(dǎo)和規(guī)范企業(yè)開展一致性評價工作”。并且,是否獲批一致性評價是由總局一致性評價辦公室審核批準(zhǔn)的。
而本次公布的信息并沒有在“仿制藥一致性評價”公布,也沒有一致性評價辦公室審核批準(zhǔn)通過的信息。這就讓大家產(chǎn)生疑問——以這種模式公布,是否意味著此3個產(chǎn)品就是通過一致性評價了?今后是否通過一致性評價的產(chǎn)品都是以這種模式?
截至2017年1月15日,CFDA每月公布的藥品上市清單中,僅僅是在2016年11月公布的成都倍特藥業(yè)的富馬酸替諾福韋二吡呋酯片(國藥準(zhǔn)字H20163436)上市,暫未公布齊魯制藥(海南)生產(chǎn)的吉非替尼片和上海迪賽諾生物生產(chǎn)的依非韋倫片。
分析咸達(dá)數(shù)據(jù)V3.2數(shù)據(jù)庫發(fā)現(xiàn),在CFDA數(shù)據(jù)庫中,國內(nèi)已上市數(shù)據(jù)庫可以查到齊魯制藥(海南)的吉非替尼片(國藥準(zhǔn)字H20163465)的批文,在“藥品注冊進度查詢”可得上海迪賽諾生物的依非韋倫片(國藥準(zhǔn)字H20163464)的批文。
若要論及此3個產(chǎn)品的共性,就是它們都是第一批臨床自查核查目錄產(chǎn)品,對應(yīng)2015年第117號公告,這3個產(chǎn)品都沒有公告撤回。只有齊魯制藥(海南)的吉非替尼片在藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃目錄中,對應(yīng)第5號公告。
機會總是留給有準(zhǔn)備的人。這3個產(chǎn)品若被證實通過一致性評價,則表示他們在2015年以前就是以一致性評價的要求去研發(fā)項目。
試驗數(shù)據(jù)現(xiàn)場核查計劃 2017第一單
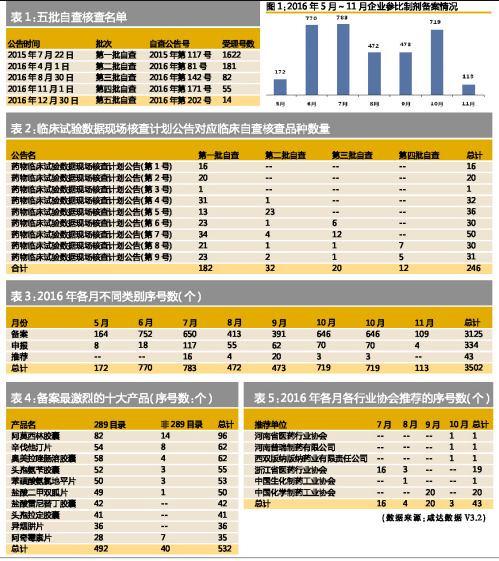
2017年1月初,CFDA發(fā)布2016年最后一批臨床核查自查第202號的14個,如表1所示,合計1954個受理號進入臨床核查自查目錄名單。
2017年1月13日,CFDA食品藥品審核查驗中心(CFDI)公布了藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第9號),合計31個受理號。9批藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃中,主要來自第一批自查臨床核查自查目錄合計182個受理號。再加上第一批自查臨床核查自查目錄中主動撤回的注冊申請317個,申請減免臨床試驗等不需要提交的注冊申請193個,公告撤回876個,公告不批準(zhǔn)的40個,這些情況合計1608個受理號。
考慮到第一批自查臨床核查自查目錄共1622個受理號,這意味著第一批臨床自查核查目錄的臨床核查已接近尾聲,有望在2017年上半年完成所有臨床試驗數(shù)據(jù)現(xiàn)場核查。
進口藥是9批藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃中占比最高的分類,占53.3%。諾華是受理號數(shù)最多的企業(yè)。
參比制劑備案數(shù) 10月進一步回升
2016年11月29日,中國食品藥品檢定研究院公開2016年9月1日至30日期間備案信息,9月企業(yè)參比制劑備案序號數(shù)進一步下降到414個。其中企業(yè)“備案”下降到335個,企業(yè)“申報”(即認(rèn)為自己生產(chǎn)的產(chǎn)品可作為參比制劑,主要是原研廠家以及在歐美上市的仿制藥廠家申報)有所回升為59個,行業(yè)推薦則是近3個月的最高為20個。
2017年1月13日,中國食品藥品檢定研究院公布2016年10月1日至11月4日期間備案信息,其中10月的企業(yè)制劑備案序列號數(shù)回升到700以上的水平。
以類別來看,2016年10月企業(yè)“備案”回升到646個,企業(yè)“申報”回升到70個,行業(yè)推薦則是僅有3個。
2016年5月至11月共備案3502個,其中屬于必需在2018年完成一致性評價的受理號共1915個,占比54.7%。
阿莫西林膠囊、辛伐他汀片、奧美拉唑腸溶膠囊、頭孢氨芐膠囊和苯磺酸氨氯地平片是五大備案數(shù)最多的產(chǎn)品,同樣也是289目錄中最受企業(yè)關(guān)注的五大品種。289目錄中,阿莫西林膠囊的競爭廠家超過50家,奧美拉唑腸溶膠囊超過40家,可見競爭之激烈。
2016年10月“申報”的最多的跨國企業(yè)是阿斯利康,5月至10月申報最多的依然是輝瑞。
國內(nèi)企業(yè)也有不少在10月首次申報自己產(chǎn)品為參比制劑。如湘北威爾曼制藥申報注射用哌拉西林鈉舒巴坦鈉(2:1),大同市藥物研究所申報膠體果膠鉍膠囊,華潤紫竹藥業(yè)和湖北葛店人福藥業(yè)都申報了米非司酮片。
推薦方面,10月真正屬于行業(yè)協(xié)會推薦的是河南省醫(yī)藥行業(yè)協(xié)會,推薦河南普瑞制藥的消旋山莨菪堿片作為參比制劑。
結(jié)語<<<
申報生產(chǎn)注冊時已按一致性評價要求的產(chǎn)品,獲批的可能性就更大,這表示仿制藥生產(chǎn)企業(yè)要想在一致性評價中獲得優(yōu)勢位置,必須加快進度。
此外,一些過一致性評價的藥品是在中國境內(nèi)用同一條生產(chǎn)線生產(chǎn)上市并在歐盟、美國或日本獲準(zhǔn)上市的藥品,也在2016年開始積極申報一致性評價資質(zhì),這預(yù)示著2017年會有一批高要求的企業(yè)獲得一致性評價。









 相關(guān)新聞
相關(guān)新聞