一是大批原研轉地產化,二是仿制藥歐美日共線上市產品,三是大量的海外新藥。
一是大批原研轉地產化,二是仿制藥歐美日共線上市產品,三是大量的海外新藥。
2017年,中國制藥工業與全球接軌之路來得比想象中迅速,仿制藥一致性評價則隨著政策的松動門檻降低,競爭加劇。
大批原研轉地產化、仿制藥歐美日共線上市產品和大量的海外新藥國內同步上市,將對國內仿制藥形成巨大沖擊。
過期原研藥:原研地產化無需一致性評價
6月9日,CFDA總局發布了2個關于仿制藥質量和療效一致性評價的公告的征求意見稿,業界將之視為CFDA總局對一致性評價政策調整的信號——CFDA總局此前制定的一致性評價政策的要求過高,從而導致國內企業難以開展實施,為了解決上述困境,CFDA對相關的政策做了調整。
以參比制劑原研藥品地產化的調整為例。參比制劑遴選順序調整為:(一)原研藥品:進口原研藥品、原研企業在中國境內生產上市的藥品,未進口原研藥品;(二)在原研企業停止生產的情況下,可選擇美國、日本或歐盟獲準上市并獲得參比制劑地位的藥品。與此同時,“原研企業在中國境內生產上市的藥品”(即原研地產化產品)被上升到“原研藥品”的地位。
原研地產化產品除了地位上升,一致性評價相關流程也被簡略了:如果未發生較大變更的且質量療效與原研產品質量無差異的無需開展一致性評價。《關于仿制藥質量和療效一致性評價工作有關事項的公告》將《關于落實〈國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見〉有關事項的公告》中原定“原研藥品地產化品種須開展一致性評價”,修改為“根據變更情況分類處理:屬于上市后未發生較大變更的,或上市后發生較大變更但經審評后不影響質量和療效的,經過食品藥品監管總局審核和核查后,可以選擇為參比制劑。屬于上市后發生重大變更并與原產國同產品質量療效存在差異的,由企業在本公告發布30天內對社會發布聲明,說明存在的差異及原因,并按照要求開展一致性評價”。
原研地產化的流程簡略短期利好原研地產化廠家。長期而言,專利過期原研產品還是要面臨國產廠家過一致性評價后的招標政策改革,并釋放一部分市場給過一致性評價的國產廠家。
國內仿制藥:成本戰正式打響
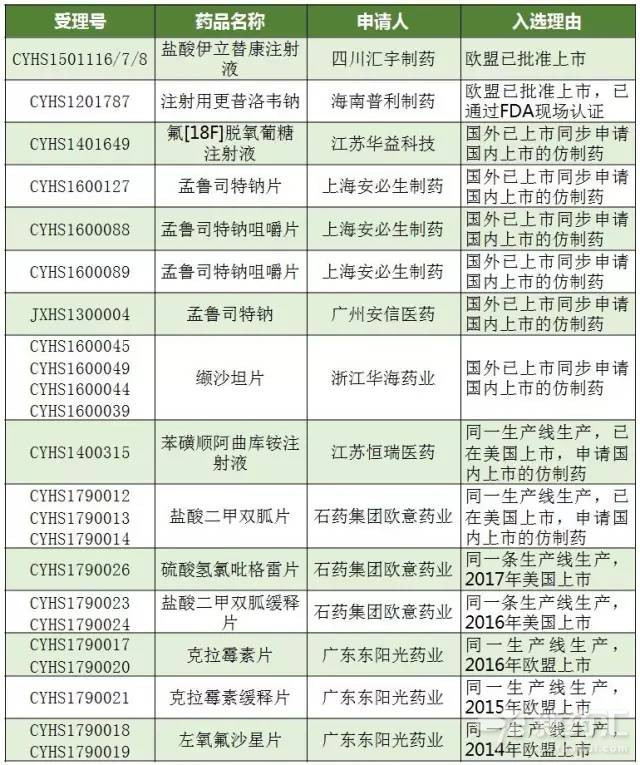
支持中國境內企業生產的在歐盟、美國或日本批準上市的藥品在中國上市的政策落地已在2017年加快。截至2017年6月12日,表1所示的共有23個受理號以境內共線生產并在歐美日上市品種理由獲得“擬納入優先審評程序藥品注冊申請”,其中2017年共計12個受理號數。
表1 擬納入優先審評的雙報名單
(數據來源:識敏信息)
石藥和東陽光是獲得“擬納入優先審評程序藥品注冊申請”產品最多的廠家,石藥集團歐意藥業有限公司對應的產品有鹽酸二甲雙胍片、鹽酸二甲雙胍緩釋片和硫酸氫氯吡格雷片。廣東東陽光藥業有限公司對應的有克拉霉素片、克拉霉素緩釋片和左氧氟沙星片。
中國境內企業生產的在歐盟、美國或日本批準上市但未在中國境內上市的藥品,經臨床研究證實無種族差異的,可使用境外上市申報的生物等效性研究、藥學研究數據等技術資料向食品藥品監管總局(藥品審評中心)提出上市申請;可能存在種族差異的,應開展相應的臨床試驗。這標志著中國境內企業生產的在歐盟、美國或日本批準上市但未在中國境內上市的藥品有望免臨床直接上市。
中國已進入WHO組織,亦有意加入ICH,下一步也很有可能對歐美日已上市的仿制藥開放同等的政策優待。或允許國內生產廠家獲得歐美日已上市生產廠家(非我國公民持股)的仿制藥技術授權后,只要被上市國認可產地就可享受共線雙報的政策。
對于國內生產廠家而言,仿制藥市場競爭激烈加劇。一方面,國內一致性評價藥品的項目成本一直居高不下(項目整體投入超過1000萬元);另一方面,境內共線生產并在歐美日上市品種將在本次一致性評價競爭中獲得先機。仿制藥的政策變動將影響仿制藥的競爭格局。無論如何變更,成本戰是未來仿制藥的競爭方向。
國內企業必須開始算一本賬——對于中小型企業而言,究竟是去買有風險的第三方研發機構的一致性評價項目,還是自己研發不停試錯建立自己研發團隊?抑或通過境外并購獲得海外技術以及海外的原料藥?這些路徑,究竟哪種成本相對更合理,時間更快?
從市場格局而言,只要利潤空間夠、沒有首仿等政策保護以及注冊審批時間合理,未來很難出現市場規模可觀的仿制藥實際生產廠家數在3家以內的狀況。只要是好產品,就會有廠家爭搶。成本控制將會是各仿制藥廠家未來必須學會的一門重要必修課。
展望<<<
新藥價值投資將要繁榮
政策改革整體利于創新,仿制藥競爭格局激烈程度和海外市場準入難更是將行業在沒有準備好的情況下被倒逼著要迅速學會引進新藥、開展首推藥項目。筆者較為困惑的是,市場競爭加劇后,以往不過不失的“me-too”藥是否還能繼續有好業績?
創新藥特別是國內科研院校的新藥項目成功率較低,國內企業不敢貿然投入。為了追求成功率,接受境外數據的政策一旦實施,國內企業將會更積極地從海外引進成熟度較高的新藥項目,將海外新藥的國內權益買斷等都是解決方案。
目前海外的新藥回報機制是國內大多數中小藥企難以承擔的。新藥項目估值評估的關鍵是藥品的臨床價值,臨床價值往往是基于藥品臨床試驗數據做的評估。中國長期從事仿制藥開發,缺乏新藥臨床試驗的經驗人才。若企業要建立新藥體系,短期來看引導海外華人科學家高薪回流將會是大趨勢。








 相關新聞
相關新聞