前 言
近年來(lái)生物類似藥(biosimilars)越來(lái)越受重視,許多生物制品(如英利昔單抗、促紅細(xì)胞生成素Epogen等)的類似藥已在FDA備案,促白細(xì)胞生成基因工程藥Neupogen的生物類似藥Sandoz’s Zarxio已于2015年9月在美國(guó)上市。
一、什么是生物類似藥?
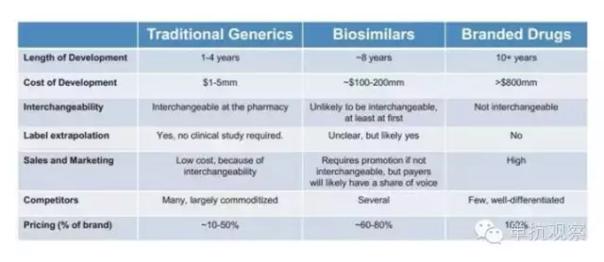
與小分子化藥類似藥相似,生物類似藥是指與上市生物藥品“高度相似”的后續(xù)生物產(chǎn)品,但是生物類似藥的結(jié)構(gòu)比化藥仿制藥要復(fù)雜得多。因此,生物類似藥市場(chǎng)也與傳統(tǒng)的小分子仿制藥市場(chǎng)不同:生物類似藥市場(chǎng)的門檻更高,需要復(fù)雜的技術(shù)和更大、更長(zhǎng)時(shí)間的投資;同時(shí),這個(gè)領(lǐng)域的競(jìng)爭(zhēng)者較少,價(jià)格也較穩(wěn)定;另外,生物類似藥最初不易互相換用。
二、生物類似藥研發(fā)分5個(gè)階段
蛋白測(cè)序是生物類似藥的第一步,蛋白序列必須與原分子精確匹配,不能完全依賴公開發(fā)布的數(shù)據(jù)。糖基化屬性匹配是達(dá)到生物相似性的關(guān)鍵,這會(huì)影響PK/PD性質(zhì)、安全性和有效性,并且這一步容易受到細(xì)胞系和生長(zhǎng)環(huán)境的影響。第三步是掌握相關(guān)知識(shí)產(chǎn)權(quán)問(wèn)題,避免后續(xù)的麻煩。這前三步都屬于分子選擇階段,即臨床前研發(fā)階段。臨床一期的PK/PD研究非常關(guān)鍵,對(duì)Cmax, AUC0→t等參數(shù)都有相關(guān)規(guī)定。最后是三期臨床確定安全性和有效性。
三、生物類似藥市場(chǎng)動(dòng)態(tài)
J.P.Morgan認(rèn)為,生物類似藥的時(shí)代即將到來(lái)。未來(lái)十年內(nèi)將有一大波生物類似藥進(jìn)入美國(guó)和歐洲市場(chǎng)(如Remicade、Neupogen、Epogen等的類似藥),同時(shí)相關(guān)的管理辦法也會(huì)建立和完善。生物類似藥也將為政府稅收創(chuàng)造實(shí)質(zhì)性的貢獻(xiàn)。
(一)生物類似藥市場(chǎng)不是一夜之間蓬勃起來(lái)的:
1. 即使是很保守的估計(jì),2025年生物類似藥的市場(chǎng)額將到達(dá)200億元
2. 我們預(yù)計(jì)在美國(guó)生物類似藥的價(jià)格會(huì)下降20%-40%
生物類似藥的價(jià)格仍然有爭(zhēng)議,但多位業(yè)內(nèi)人士指出在美國(guó)其價(jià)格將會(huì)下降20%-40%。
美國(guó)生物類似藥的價(jià)格取決于和納稅人協(xié)商的結(jié)果
納稅結(jié)構(gòu)的改變可能是導(dǎo)致生物類似藥降價(jià)的一個(gè)因素
3. 生物類似藥的開發(fā)比小分子仿制藥昂貴,這也是決定其定價(jià)的一個(gè)主要原因。
應(yīng)臨床試驗(yàn)的需求,生物類似藥需要更多的研發(fā)投入
生物類似藥是不能互相替代的,因此它們需要有銷售基礎(chǔ)設(shè)施
但是由于生物類似藥提高其制造工藝,帶來(lái)產(chǎn)品的邊際效益。
4. 歐洲市場(chǎng)最終會(huì)有25%-45%的價(jià)格折扣
在歐洲生物類似藥的價(jià)格取決于市場(chǎng)結(jié)構(gòu)
由于國(guó)際招標(biāo),其市場(chǎng)價(jià)格下降30%-40%,這些市場(chǎng)包括波蘭、挪威和匈牙利,選中的市場(chǎng)將有很大的價(jià)格跌落
醫(yī)院和計(jì)劃規(guī)定的市場(chǎng),其價(jià)格將下降約25%
5. 這個(gè)類別里有很多大型西方歐盟市場(chǎng)
自由市場(chǎng)大概有20%-30%的折扣
我們希望看到原研生物藥價(jià)格能很快下降
6. 有趣的是歐盟生物類似藥在大力推行
隨著非格司亭的生物類似藥(優(yōu)保津)可使用性,我們看到尤其在歐洲發(fā)展中國(guó)家市場(chǎng)中,優(yōu)保津的使用率在不斷提高
沿著這個(gè)思路,我們不必驚訝地發(fā)現(xiàn)其他生物類似藥市場(chǎng)的不斷擴(kuò)大
(二)四個(gè)因素促使生物類似藥市場(chǎng)的規(guī)模擴(kuò)大
病人的危急程度:極少的危急情況使生物類似藥的使用擴(kuò)大
快速的反饋:如果藥物的安全性和有效性能有及時(shí)的反饋,醫(yī)生更愿意使用生物類似藥。
納稅人的影響:納稅人更多地關(guān)注生物類似藥,他們也會(huì)更愿意接受生物類似藥的使用。
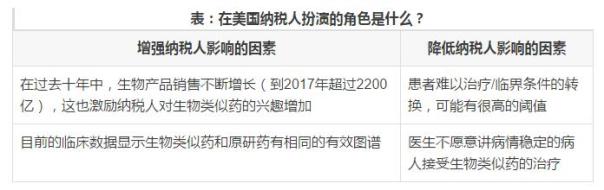
終市場(chǎng)的規(guī)模:納稅人會(huì)將注意力集中在大規(guī)模的昂貴的治療項(xiàng)目上。如下表,展示了在美國(guó),納稅人扮演的角色是什么?
(三)一些生物類似藥公司的特點(diǎn)
我們目前發(fā)現(xiàn)了許多顯著的交易和合作伙伴關(guān)系:
輝瑞和Hospira的合作推進(jìn)生物類似藥的發(fā)展
Baxalta、Coherus和 Momenta的合作
輝瑞合作開發(fā)蘭尼單抗
對(duì)于合作出現(xiàn)的利益我們也不會(huì)感到驚訝。
四、熱點(diǎn)爭(zhēng)議
生物類似藥領(lǐng)域存在許多熱點(diǎn)爭(zhēng)議問(wèn)題。
(一)整體監(jiān)管路徑變得更加清晰
生物類似藥的批準(zhǔn)可能需要一項(xiàng)PK/PD研究,大多數(shù)情況下指的是臨床III期面對(duì)面的非劣效性研究。因?yàn)槲覀冎溃^大多數(shù)的新藥研發(fā)通過(guò)成功的I期PK/PD研究降低風(fēng)險(xiǎn)。 在過(guò)去幾年,歐盟批準(zhǔn)了幾個(gè)生物類似藥,而美國(guó)也在2015年批準(zhǔn)了首個(gè)生物類似藥。其中,主要的初期生物類似藥目靶標(biāo)有Neupogen/Neulasta, Epogen和TNF。一般說(shuō)來(lái),在適應(yīng)證的作用機(jī)制相似的情況下,我們希望監(jiān)管機(jī)構(gòu)允許標(biāo)簽外推。在這一方面,我們密切關(guān)注TNF在美國(guó)的動(dòng)態(tài)。然而,我們也不期望在短期內(nèi)的可交換性。
1. 在大多數(shù)情況下我們希望標(biāo)簽外推
一般來(lái)說(shuō),在大多數(shù)情況下我們希望標(biāo)簽外推。FDA和EMA允許在不同疾病狀態(tài)下成分作用方式相似的藥物進(jìn)行合理的標(biāo)簽外推。然而包括幾家大型生物制藥企業(yè)在內(nèi)的許多公司,都只對(duì)一個(gè)適應(yīng)證進(jìn)行大型的III期試驗(yàn)。
2. 然而,在不同市場(chǎng)上市的藥物的標(biāo)簽外推法尚不清楚
有幾個(gè)外推尚不清楚的情況,特別是當(dāng)一個(gè)藥物在不同市場(chǎng)上市時(shí)。當(dāng)EMA根據(jù)生物類似藥Remicade在類風(fēng)濕性關(guān)節(jié)炎的數(shù)據(jù)批準(zhǔn)其所有適應(yīng)證時(shí),加拿大衛(wèi)生部考慮到ADCC可能在克羅恩病和潰瘍性結(jié)腸炎中發(fā)揮作用,而沒(méi)有批準(zhǔn)該生物類似藥的這些適應(yīng)證。最近匈牙利在克羅恩病和潰瘍性結(jié)腸炎方面的Inflectra/Remsima有效性數(shù)據(jù)應(yīng)該有助于緩解這些問(wèn)題。而美國(guó)的AdCom專門小組對(duì)其延期,可能在等待支持外推適應(yīng)證的數(shù)據(jù)。生物類似藥Rituxan是另一個(gè)爭(zhēng)議情況的代表,目前尚不清楚其在腫瘤方面的RA數(shù)據(jù)是否足夠其通過(guò)批準(zhǔn)。
3. 即使有外推法,數(shù)據(jù)的缺乏仍可能是一個(gè)挑戰(zhàn)
當(dāng)我們期待標(biāo)簽外推時(shí),我們看到醫(yī)生是以數(shù)據(jù)為導(dǎo)向的。直到最近,Inflectra(生物類似藥Remicade)在GI適應(yīng)證(克羅恩病和潰瘍性結(jié)腸炎)方面沒(méi)有臨床數(shù)據(jù),還受到了來(lái)自歐洲的一些腸胃病學(xué)家的抵制。出于商業(yè)原因,幾個(gè)提到過(guò)的生物類似藥在進(jìn)行其他適應(yīng)證的小型臨床研究。而根據(jù)我們的談話所知,醫(yī)生更喜歡他們遇到的疾病狀態(tài)方面的數(shù)據(jù),但是一般會(huì)認(rèn)為在最難治愈的疾病狀態(tài)下的數(shù)據(jù)也是足夠的。
4. FDA宣布標(biāo)簽指南
FDA預(yù)期將于今年宣布標(biāo)簽指南。人們關(guān)注哪些數(shù)據(jù)將被包括在內(nèi),而哪些又將排除在外;生物類似藥的標(biāo)簽與原藥分子將有什么不同。標(biāo)簽很重要,包括在提供給醫(yī)生的詳細(xì)數(shù)據(jù)中,標(biāo)簽可以用于區(qū)分不同的生物類似藥。
5. INN命名約定仍不明朗
生物類似藥物是否會(huì)與原藥分子使用相同的INN命名仍未可知。生物類似藥公司希望采用相同的通用INN名,但是原藥公司稱采用不同的命名對(duì)于市場(chǎng)后期的安全分析非常重要。FDA建議每個(gè)生物類似藥有一個(gè)獨(dú)特的后綴,但未統(tǒng)一后綴是否須有實(shí)義。而歐洲卻支持使用與原藥相同的INN名。然而,我們希望公司為生物類似藥重新命名以更好地支持銷售和市場(chǎng)工作。
6. 我們并不期望在不久的將來(lái)出現(xiàn)可替代的生物類似藥
在美國(guó),可替代性的指導(dǎo)方針仍不清楚。FDA計(jì)劃在“不久的將來(lái)”發(fā)行可替代性指導(dǎo),這將可能涉及轉(zhuǎn)換研究。可替代性與標(biāo)簽外推如何貫穿將會(huì)很有趣,即生物類似藥在所有適應(yīng)證上都能替代嗎?而歐盟不允許生物類似藥在藥房的替代。雖然歐盟用“可替代”一詞來(lái)形容生物類似藥,但是在沒(méi)有處方醫(yī)生同意的情況下,生物類似藥不可作為替代藥物。 綜上,我們并不期望在不久的將來(lái)出現(xiàn)可替代的生物類似藥。
(二)法律/IP是被低估了風(fēng)險(xiǎn)的障礙
1. IP是一個(gè)關(guān)鍵的不確定因素
生物類似藥生產(chǎn)商在尋求將產(chǎn)品推廣到市場(chǎng)時(shí)面臨大范圍的出色I(xiàn)P。與列出可能推遲批準(zhǔn)通用藥物的產(chǎn)品和專利的小分子橙皮書不同,紫皮書目前只列出了產(chǎn)品和不適用的專利。生物類似藥企業(yè)必須依靠他們自己內(nèi)部對(duì)原藥相關(guān)專利的法律進(jìn)行評(píng)估。而這樣的評(píng)估可能在很大程度上并不可測(cè),直到351(k) 生物類似藥注冊(cè)審批文件的推出,才觸發(fā)了BPCIA下創(chuàng)建的專利解決逐步程序。
2. 原藥生產(chǎn)商繼續(xù)發(fā)布額外的IP文件
原藥生產(chǎn)商繼續(xù)申請(qǐng)專利,在專利發(fā)行之前可能會(huì)有不完整的IP出現(xiàn)。在我們看來(lái),在IP方面的工作能力是一個(gè)關(guān)鍵因素,我們將繼續(xù)關(guān)注對(duì)IP的額外描述和不同公司在操控這些專利上的能力。例如,Humira IP estate 包括大約150個(gè)專利和50個(gè)未決申請(qǐng),其中半數(shù)為配方和成分專利。而進(jìn)一步的產(chǎn)品線延伸,新配方或組合工作是創(chuàng)新者潛在的生命周期管理工具。
3. BPCIA和訴訟程序中的不確定性
351(k)BLA申請(qǐng)后,BPCIA列出了一個(gè)大約250天的程序,在這個(gè)程序里原藥生產(chǎn)商和生物類似藥生產(chǎn)商協(xié)商對(duì)哪一項(xiàng)專利提出訴訟。值得注意的是,訴訟獨(dú)立于FDA程序,并且沒(méi)有30個(gè)月的保留和三倍的賠償。沿著這些線路,原藥生產(chǎn)商需要尋求阻止生物類似藥生產(chǎn)商啟動(dòng)程序的禁令。而就算生物類似藥生產(chǎn)商向原藥生產(chǎn)商公開申請(qǐng)失敗,F(xiàn)DA也無(wú)權(quán)因此拒絕生物類似藥生產(chǎn)商的批準(zhǔn)。在Amgen和Sandoz的案例中,法院裁決贊成Sandoz,意味著生物類似藥公司可以選擇是否參與BPCIA專利交換程序。
4. 從最近和正在進(jìn)行中的訴訟中獲得的啟示
Amgen v. Sandoz: 法院裁決表明生物類似藥生產(chǎn)商可以選擇是否參與BPCIA專利交換過(guò)程。然而,法院裁定在這種情況下,Sandoz在生物類似藥批準(zhǔn)后,而非批準(zhǔn)前,給出180天的商業(yè)營(yíng)銷通知。一些專家認(rèn)為,這一裁決可能特定于這一事實(shí)模式(即Sandoz不參與專利交換程序),并期待在未來(lái)案例中有潛在更新。 其他案例: AMGN v. Apotex and JNJ v. HSP/Celltrion: 在兩個(gè)案例中,生物類似藥生產(chǎn)商均作為申請(qǐng)人參與專利交換程序 JNJ v. HSP/Celltrion:Celltrion半途提前終止其專利交換程序,并迫使Janssen提出訴訟 AMGN v. Apotex: 也包括138個(gè)制造專利,Coherus聲稱其并不構(gòu)成侵犯。
5. 專利訴訟時(shí)間
傳統(tǒng)的專利訴訟時(shí)間大約4-5年,多方復(fù)審時(shí)間大約2.5年。在沒(méi)有高危發(fā)行的情況下,即使IP有效,專利訴訟和/或多方復(fù)審可能會(huì)對(duì)預(yù)期的發(fā)行時(shí)間增加2.5-5年。比如Humira的類似藥至少要在2018年的年中才能進(jìn)入市場(chǎng)。
五、一些生物類似藥的典型案例
1. 抗TNF生物藥:新患者的出現(xiàn)發(fā)推動(dòng)生物類似藥的應(yīng)用
我們預(yù)測(cè)大多數(shù)新患者將采用生物類似藥治療
但是,我們認(rèn)為(至少在初期)將傳統(tǒng)藥物治療穩(wěn)定的患者轉(zhuǎn)向生物類似藥治療是很困難的TNF生物藥市場(chǎng)中有很多病人是來(lái)自傳統(tǒng)藥物治療很多年的患者。根據(jù)醫(yī)生和納稅人的對(duì)話,我們認(rèn)為在最初幾年將病人治療從傳統(tǒng)模式轉(zhuǎn)換到生物類似藥的治療是很困難的。盡管一些生物類似藥研發(fā)的團(tuán)隊(duì)正在研究適用傳統(tǒng)藥物的病人是否可以轉(zhuǎn)換到生物類似藥,醫(yī)生做出這種決定需要更長(zhǎng)期的結(jié)果。
2. 抗TNFs:歐洲的經(jīng)驗(yàn)
韓國(guó)的Hospirahe 美國(guó)的Celltrion聯(lián)合開發(fā)的Inflectra/Remsima(生物類似藥是Remicade)去年在歐洲市場(chǎng)占有率達(dá)到20%,并在2015年二月份擴(kuò)大。
大部分市場(chǎng)可見30%的價(jià)格降低,在一些特殊地區(qū)的市場(chǎng)(挪威、芬蘭)可以見到價(jià)格急劇下降。生物類似藥的早期市場(chǎng)中,默克公司發(fā)現(xiàn)一些患者從傳統(tǒng)治療向生物類似藥的治療轉(zhuǎn)變,并且保持著生物類似藥的治療,可見這是一個(gè)很大的市場(chǎng)。
3.抗TNFs: 潛在的阿達(dá)木單抗商業(yè)戰(zhàn)爭(zhēng)
在生物類似藥的世界,艾伯維參考了阿達(dá)木的特許經(jīng)營(yíng)商業(yè)策略。阿達(dá)木單抗的適用人群廣是一個(gè)競(jìng)爭(zhēng)優(yōu)勢(shì),尤其體現(xiàn)在其患者都是長(zhǎng)期使用的穩(wěn)定的群體。由于群體大,艾伯維可以提供回扣,從而對(duì)納稅人有利,即使和群體少但價(jià)格便宜的生物類似藥相比也很有競(jìng)爭(zhēng)優(yōu)勢(shì)。結(jié)果是,艾伯維在市場(chǎng)上占據(jù)有利地位。
另外,我們預(yù)測(cè)除了類風(fēng)濕性關(guān)節(jié)炎和牛皮癬,仍有超過(guò)40%的患者使用阿達(dá)木單抗,這也是限制了生物類似藥使用的主要原因。
據(jù)我們所知,生物類似藥公司正在對(duì)類風(fēng)濕性關(guān)節(jié)炎和牛皮癬進(jìn)行臨床III期的實(shí)驗(yàn)。即使生物類似藥被授予安全可靠的標(biāo)簽,醫(yī)生在使用這些藥物時(shí)還是以臨床數(shù)據(jù)為主要依據(jù),從而臨床數(shù)據(jù)是決定生物類似藥使用的關(guān)鍵因素。
4.抗TNFs:阿達(dá)木的新制劑提供了額外的市場(chǎng)保護(hù)
艾伯維開發(fā)新的制劑,在申請(qǐng)F(tuán)DA和EMA,并且在不斷地開發(fā)新設(shè)備。申請(qǐng)專利建議新制劑可能涉及到室溫穩(wěn)定性,注射部位低反應(yīng)性,高劑量,以及無(wú)針設(shè)備。我們關(guān)注新制劑的更新,在2015年可能會(huì)被審批。新制劑是否可以提高患者的治療體驗(yàn),艾伯維將會(huì)有多少患者群體的轉(zhuǎn)換,以及新制劑是否可以保護(hù)阿達(dá)木的特許經(jīng)營(yíng),這些都是不清楚的。
5.G-CSGs:我們期望生物類似藥有顯著的市場(chǎng)侵入率
和TNFs不同,我們期望G-CSFs生物類似藥有一個(gè)較廣的市場(chǎng)占有率。
G-CSFs的使用比較短,因此醫(yī)生/納稅人能更輕松的切換患者群體。
另外幾個(gè)因素也說(shuō)明這個(gè)家族的生物類似藥市場(chǎng)比重高G-CSFs是通過(guò)醫(yī)院渠道,因此成本導(dǎo)向的GPOs就有舉足輕重的地位。市場(chǎng)中有相當(dāng)一部分費(fèi)用可通過(guò)醫(yī)保B部分報(bào)銷,醫(yī)生切換到生物類似藥就有額外費(fèi)用獎(jiǎng)勵(lì)。
6.G-CSFs:歐洲得出的經(jīng)驗(yàn)
在歐洲,非格司亭(優(yōu)保津)生物類似藥已經(jīng)占據(jù)超過(guò)50%的短效G-CFS市場(chǎng),五年之內(nèi),非格司亭的市場(chǎng)占有率將超過(guò)75%。
在歐洲,山德士的Zarzio有超過(guò)30%的患者群,超過(guò)了優(yōu)保津。
另外,我們發(fā)現(xiàn)隨著藥物價(jià)格的降低,使用G-CSF的人群在擴(kuò)大。
7.G-CSFs:在美國(guó)Granix啟動(dòng)的趨勢(shì)
Teva公司的Granix(TBO-非格司亭)在2012年被批準(zhǔn)作為一種新型的生物藥物(作用35(a)途徑)
根據(jù)艾美仕市場(chǎng)研究公司調(diào)查,Granix去年已經(jīng)產(chǎn)生了125百萬(wàn)美元的盈利。
價(jià)格相當(dāng)于優(yōu)保津25%的折扣價(jià),并且占據(jù)25%的銷售市場(chǎng)。
不符合外推,僅允許非骨髓惡性腫瘤患者接受化療時(shí)用來(lái)減少中性粒細(xì)胞。
8.G-CSFs:醫(yī)療B部分的報(bào)銷會(huì)擴(kuò)大該類藥的市場(chǎng)占有率
健康與人口服務(wù)部最近在支持退出B部分的生物類似藥的報(bào)銷指南。
“美國(guó)銷售價(jià)格+6”報(bào)銷政策推動(dòng)G-CSFs的市場(chǎng)擴(kuò)大。 若美國(guó)銷售價(jià)格可行,那么生物類似藥的醫(yī)療報(bào)銷可以達(dá)到其WAC的106%。在美國(guó)銷售價(jià)格實(shí)施之后,醫(yī)療報(bào)銷可以達(dá)到生物類似藥美國(guó)銷售價(jià)格的100%和參考產(chǎn)品價(jià)格的6%。









 相關(guān)新聞
相關(guān)新聞