化學(xué)藥注冊分類改革,對行業(yè)發(fā)展無疑有深遠(yuǎn)影響。自2016年3月發(fā)布《化學(xué)藥品注冊分類改革工作方案》對化學(xué)藥注冊進(jìn)行新分類,至今已過一年有余。
行業(yè)立項現(xiàn)狀究竟如何變化?為此,筆者對2017年上半年化學(xué)藥生產(chǎn)申報情況的相關(guān)數(shù)據(jù)進(jìn)行分析。2017年上半年,生產(chǎn)申服依然以化學(xué)藥申報為主,沒有中成藥報產(chǎn),也沒有化學(xué)藥新2類報產(chǎn)。
新1類:2個替尼
新1類(化藥1類新藥)有2個報產(chǎn),2個都是替尼類,分別為正大天晴藥業(yè)集團(tuán)股份有限公司和南京愛德程寧欣藥物研發(fā)有限公司申報的鹽酸安羅替尼膠囊,以及和記黃埔醫(yī)藥(上海)有限公司申報的呋喹替尼膠囊。另外,生物藥還有1個1類新藥,為康希諾生物股份公司和中國人民解放軍軍事醫(yī)學(xué)科學(xué)院生物工程研究所共同申報的重組埃博拉病毒病疫苗。
鹽酸安羅替尼膠囊此前已啟動的臨床項目適應(yīng)癥包括晚期非小細(xì)胞肺癌、小細(xì)胞肺癌,晚期甲狀腺髓樣癌、分化型甲狀腺癌,以及晚期軟組織肉瘤、結(jié)直腸癌、晚期腎細(xì)胞癌、軟組織肉瘤、晚期胃癌、晚期胃食管結(jié)合部腺癌、食管鱗癌。鹽酸安羅替尼膠囊以與現(xiàn)有治療手段相比具有明顯治療優(yōu)勢和重大專項為由被納入優(yōu)先審評品種名單。
重組埃博拉病毒病疫苗同樣以創(chuàng)新藥注冊申請和重大專項被納入優(yōu)先審評品種名單。呋喹替尼膠囊暫未申報優(yōu)先審評,呋喹替尼膠囊已啟動的臨床項目適應(yīng)癥包括結(jié)直腸腫瘤(CRC)、實體惡性腫瘤、非小細(xì)胞肺癌和晚期胃癌。
新3類:以注射劑為主
化學(xué)藥新三類以原料藥和注射劑申報為主。

注射用紫杉醇(白蛋白結(jié)合型)是近幾年比較熱的產(chǎn)品,2016年后申報生產(chǎn)的廠家有石藥集團(tuán)歐意藥業(yè)有限公司、江蘇康禾生物制藥有限公司和江蘇恒瑞醫(yī)藥股份有限公司。2017年江蘇恒瑞醫(yī)藥股份有限公司以舊6類報產(chǎn)。石藥集團(tuán)歐意藥業(yè)有限公司和江蘇恒瑞醫(yī)藥股份有限公司都獲得優(yōu)先審評的資質(zhì)。江蘇康禾生物制藥有限公司2017年以新3類報產(chǎn),預(yù)計申報的是未在國內(nèi)上市的規(guī)格。
恒瑞報產(chǎn)的注射用替莫唑胺適應(yīng)癥為新診斷的多形性膠質(zhì)母細(xì)胞瘤成人患者,以及用亞硝基脲和甲基芐肼常規(guī)治療后復(fù)發(fā)或進(jìn)展的間變性星形細(xì)胞瘤成人患者。恒瑞2015年曾以舊化學(xué)藥分類3.3報產(chǎn),止步于第一批床自查核查,本次以新3類再次報產(chǎn)。注射用替莫唑胺已完成臨床的還有江蘇奧賽康藥業(yè)有限公司。替莫唑胺口服藥2016年樣本醫(yī)院市場4.8億元。
止步于第一批床自查核查再次報產(chǎn)的還有武漢大安制藥有限公司首仿氟比洛芬酯注射液,原是第一家首仿報產(chǎn),現(xiàn)在被重慶藥友制藥有限責(zé)任公司2016年“超車”申報而排到第二位。氟比洛芬酯注射液2016年樣本醫(yī)院市場6.2億元。武漢大安制藥有限公司產(chǎn)品如果能上市,將會改變目前北京泰德獨(dú)家的格局。
新4類、舊6類:首仿依然是熱點(diǎn)
新4類和舊6類的報產(chǎn)則以口服藥為主。有搶首仿的,如阿哌沙班片、達(dá)沙替尼片、維格列汀片和來那度胺膠囊,正大天晴藥業(yè)集團(tuán)股份有限公司、四川科倫藥業(yè)股份有限公司和江蘇豪森藥業(yè)股份有限公司在競爭阿哌沙班片,江蘇豪森藥業(yè)股份有限公司和齊魯制藥有限公司在搶仿維格列汀片,達(dá)沙替尼片2017年僅石藥集團(tuán)歐意藥業(yè)有限公司申報,來那度胺膠囊的申報方僅正大天晴藥業(yè)集團(tuán)股份有限公司。
2016年CFDA批準(zhǔn)的首仿藥產(chǎn)品,2017年也有不少廠家加入競爭行列,如富馬酸替諾福韋二吡呋酯片,安徽貝克生物制藥有限公司和蘇州特瑞藥業(yè)有限公司申報。
進(jìn)口藥(新5.1類):13個報產(chǎn)
2017年,共13個國內(nèi)未上市的進(jìn)口新藥報產(chǎn)(新化學(xué)藥分類5.1類)。其中最快獲批的當(dāng)屬阿斯利康的甲磺酸奧希替尼片,2月承辦3月就獲批了。
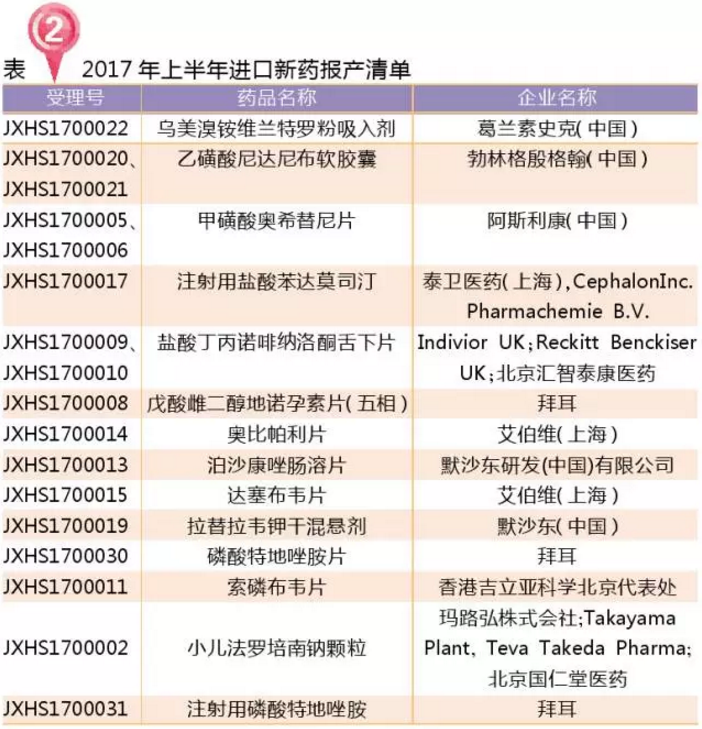
進(jìn)口仿制藥的報產(chǎn)(新化學(xué)藥分類5.2類)以原料藥為主,唯一的制劑申報是韓美的吸入用鹽酸氨溴索溶液,這也是第一批臨床自查核查撤回后的“回鍋肉”,目前國內(nèi)也僅韓美報產(chǎn)了。吸入用鹽酸氨溴索溶液目前國內(nèi)已啟動臨床的有瑞陽制藥有限公司、云南龍海天然植物藥業(yè)有限公司和吉林四環(huán)制藥有限公司。
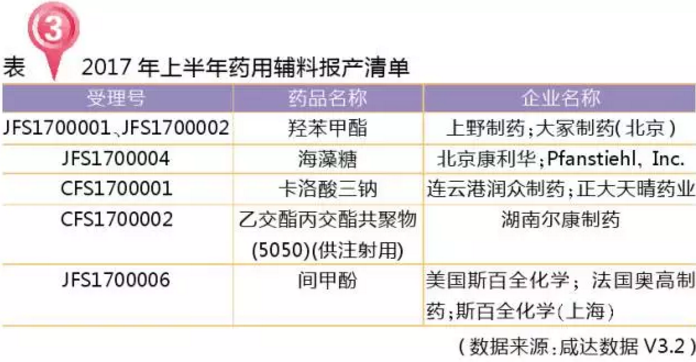
藥用輔料報產(chǎn)有新的受理號模式,進(jìn)口的前三位字母為“JFS”,國產(chǎn)的前三位字母為“CFS”,2017年上半年共5個藥用輔料報產(chǎn)。
小結(jié)<<<
從2017年申報的趨勢可看出,國內(nèi)新藥項目熱度提升,咸達(dá)數(shù)據(jù)V3.2發(fā)現(xiàn)廣東東陽光、江蘇恒瑞、石藥集團(tuán)、南京圣和、山東綠葉、廣東眾生、上海景峰、四川科倫、正大天晴等都在1類新藥積極布局。報產(chǎn)方面,化學(xué)藥搶首仿近期內(nèi)仍是熱點(diǎn)。
此外,一類臨床申報獲批的速度較快,基本2017年申報半年內(nèi)就會有審批結(jié)果。











 相關(guān)新聞
相關(guān)新聞