FDA發布48個仿制藥開發最終指導原則
為了成功開發和制造仿制藥品,申請人應期望其產品與參比制劑(RLD):在相同的使用條件下,在藥學上一致,即具有相同的活性成分、劑型、規格和給藥途徑 ;與參比制劑具有生物等效性,即在活性藥物成分的吸收速率和程度上沒有顯著差異;因而,療效上相當,即可替代參比制劑,即仿制藥與相對應的參比制劑具有相同的安全性和功效。
根據21 CFR 320.24,可以使用不同類型的證據來建立藥學上等同的藥品直接的的生物等效性,包括體內測試或體外測試,或兩者都有。用于證明生物等效性的方法的選擇取決于研究的目的、可用的分析方法和藥物產品的性質。根據這一規定,申請者必須使用21 CFR 320.24中規定的最準確、靈敏和可重現的方法進行生物等效性測試。作為選擇仿制藥產品開發方法的初步步驟,申請人可參考以下指導原則草案:根據簡化新藥申請(ANDA)提交的藥物動力學終點的生物等效性研究工業指導原則草案(2013年12月)。
為了進一步促進仿制藥產品的可及性和協助仿制藥行業確定最適合開發藥物的方法并產生支持ANDA批準所需的證據,FDA發布特定產品指南,描述FDA目前對如何開發與特定參比制劑臨床等效的仿制藥的思考和期望。
最新發布的指導原則82個(新增 21 個、修訂版 13個、最終版 48個)如下。
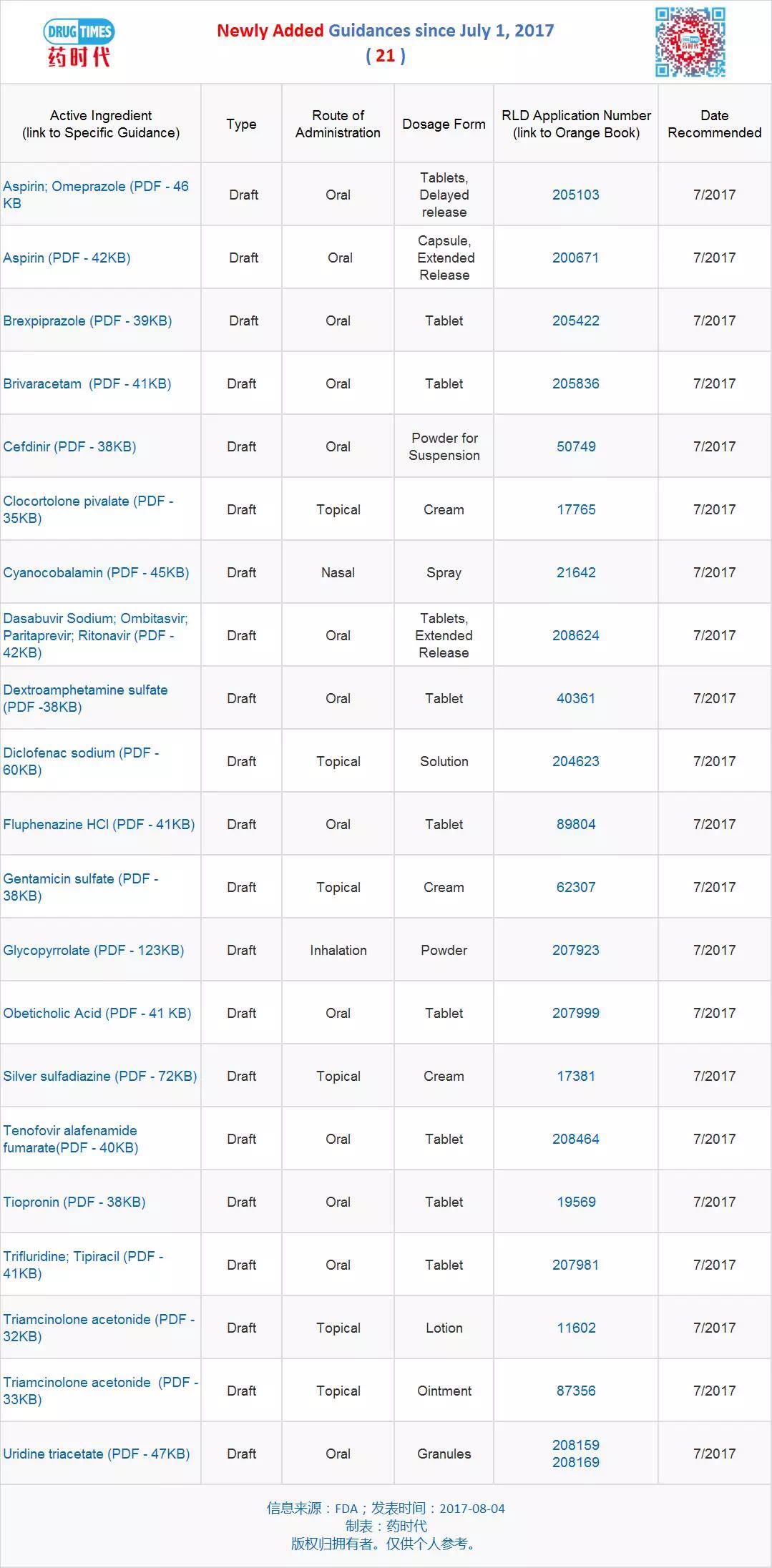
新增指導原則草案 21 個
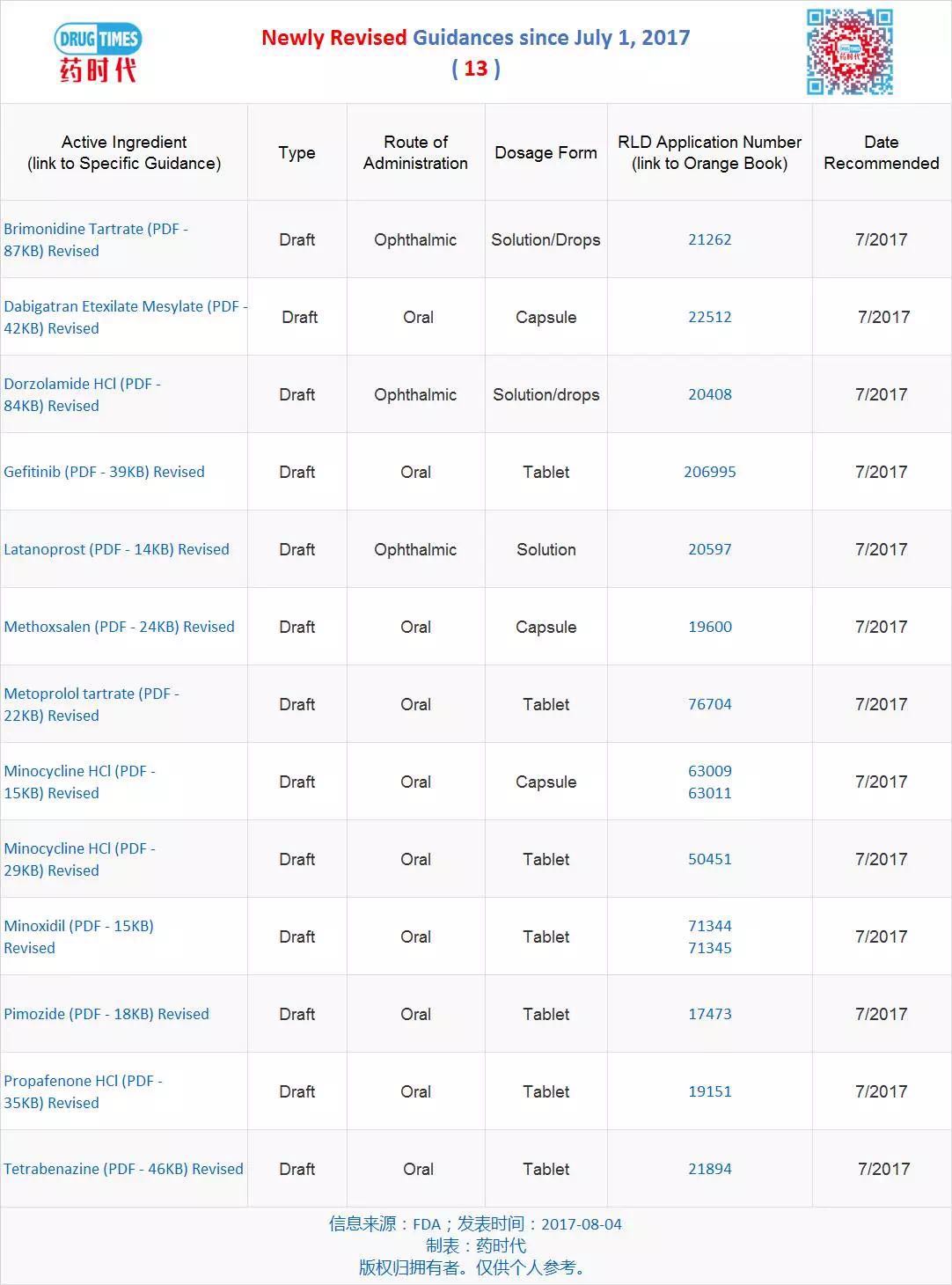
新修訂指導原則草案 13 個
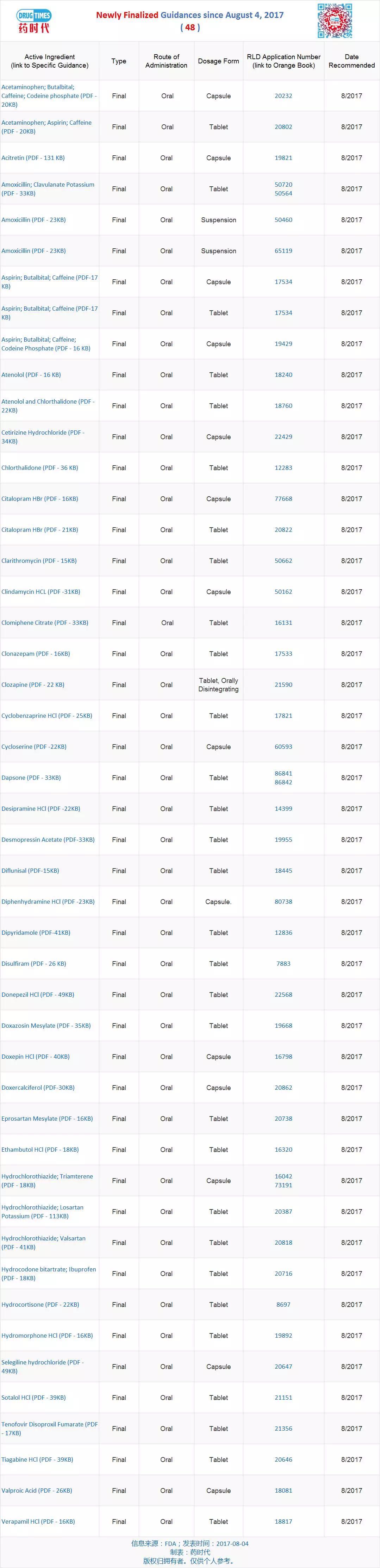
新增最終指導原則 48 個

分享到:











 相關新聞
相關新聞