【美迪西助力】治療結(jié)節(jié)病的KBMAB-16獲FDA批準(zhǔn)臨床
近日,位于成都的中國(guó)知名藥企重大項(xiàng)目KBMAB-16(靜脈注射腫瘤壞死因子-α抑制劑)孤兒藥成功獲批美國(guó)食品藥品監(jiān)督管理局(US FDA)的臨床試驗(yàn)申請(qǐng)(IND)。
上海美迪西生物醫(yī)藥股份有限公司(以下簡(jiǎn)稱“美迪西”)對(duì)此表示誠(chéng)摯的祝賀。美迪西依托合規(guī)、高效的研發(fā)技術(shù),為該項(xiàng)目提供了符合中美要求的長(zhǎng)期毒性試驗(yàn)服務(wù)。
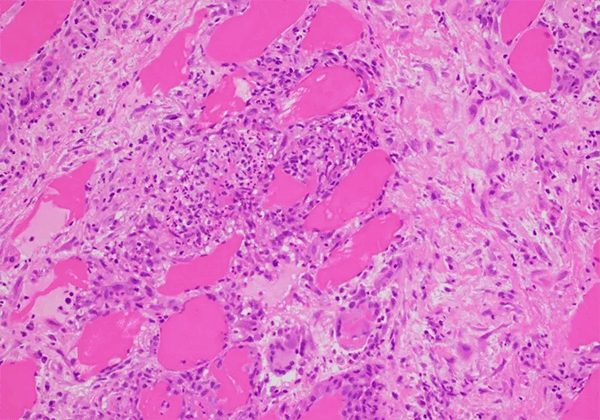
結(jié)節(jié)病是一種病因不明的慢性多系統(tǒng)炎性疾病,特征為非干酪樣上皮樣肉芽腫,伴有單個(gè)核細(xì)胞浸潤(rùn)和微結(jié)構(gòu)破壞。該病可累及皮膚,眼睛,心臟和中樞神經(jīng)系統(tǒng),超過90%的病例累及肺部。該疾病是重大的、未滿足的醫(yī)療需求之一。
作為通過FDA孤兒藥資格認(rèn)定的新藥,KBMAB-16是一種分子量約149千道爾頓的人鼠嵌合抗腫瘤壞死因子單克隆抗體,用于治療結(jié)節(jié)病伴或不伴肺外受累的新型生物制品。目前尚未有治療結(jié)節(jié)病的腫瘤壞死因子-α抑制劑獲批,但KBMAB-16作為腫瘤壞死因子-α抑制劑的理化性質(zhì)和藥理作用已進(jìn)行了大量研究。
美迪西有幸承接了KBMAB-16的長(zhǎng)期毒性試驗(yàn)。針對(duì)設(shè)計(jì)試驗(yàn)周期這一難點(diǎn),美迪西毒理學(xué)研發(fā)團(tuán)隊(duì)按照國(guó)際標(biāo)準(zhǔn),合理周密地設(shè)計(jì)試驗(yàn)方案,嚴(yán)謹(jǐn)有序地推進(jìn)項(xiàng)目,高質(zhì)高效地完成了試驗(yàn),為該藥順利獲得FDA批準(zhǔn)開展臨床試驗(yàn)提供了強(qiáng)有力的支持。
美迪西創(chuàng)始人&CEO陳春麟博士表示:“祝賀KBMAB-16成功獲得美國(guó)FDA臨床試驗(yàn)批準(zhǔn)。美迪西為參與KBMAB-16的研發(fā)感到榮幸與自豪。預(yù)祝該藥物能夠早日完成臨床研究并上市,為全球罕見病患者帶來福音。同時(shí),美迪西將繼續(xù)助力全球合作伙伴的新藥開發(fā),共同應(yīng)對(duì)人類疾病挑戰(zhàn)。”









 相關(guān)新聞
相關(guān)新聞