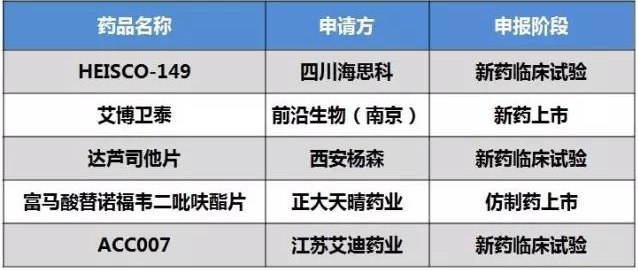
12月2日, CDE公布第十二批擬納入優(yōu)先審評程序藥品注冊申請的公示,共32個受理號被納入清單。
國外已上市同步申請國內(nèi)上市的仿制藥
本次公布的受理號清單中,入選理由為“國外已上市同步申請國內(nèi)上市的仿制藥”分別來自3個產(chǎn)品涉及9個受理號,為江蘇華益的氟[18F]脫氧葡糖注射液,廣州安信的孟魯司特鈉,上海安必生制藥的孟魯司特鈉片和孟魯司特鈉咀嚼片,以及浙江華海的纈沙坦片。以上產(chǎn)品一旦獲批,意味著他們就能獲得“一致性評價”的稱號。
咸達(dá)數(shù)據(jù)V3.2發(fā)現(xiàn),進(jìn)入第一批自查即2015年7月22日自查清單中的孟魯司特鈉咀嚼片共有4家企業(yè),分別是信東生技(受理號JXHS1100042和JXHS1100043)、揚(yáng)子江藥業(yè)集團(tuán)南京海陵藥業(yè)(受理號CYHS1190015)、北京萬生藥業(yè)(受理號CYHS1190034)和北京韓美(受理號CYHS1390027和CYHS1390028)。其中北京萬生藥業(yè)的受理號在2016年第21號公告中撤回,北京韓美的受理號分別在2015年第264號和2015年第287號中撤回。上海安必生制藥的孟魯司特鈉咀嚼片是和杭州民生濱江制藥聯(lián)合申報,預(yù)計本次優(yōu)先審評也是批人體生物等效性試驗。孟魯司特鈉咀嚼片和孟魯司特鈉片目前國內(nèi)上市的企業(yè)有魯南貝特制藥和四川大冢制藥,兩個都需要加快“一致性評價”的申報。
浙江華海藥業(yè)纈沙坦片的申報可謂一波三折,進(jìn)入第一批自查清單后,又在公告2015年第255號中撤回,雖然過FDA審批并在美國上市,這次獲得優(yōu)先審評,預(yù)計人體生物等效性試驗還是要重做。目前纈沙坦片只有常州四藥1家國內(nèi)廠家上市,競爭較激烈的是膠囊劑。
首仿品種
在第一批自查名單之中且以“首仿品種”理由入選第十二批優(yōu)先審評名單的有北京萬生藥業(yè)的鹽酸莫西沙星(受理號CXHS1400150)和鹽酸莫西沙星片(受理號CYHS1490056),它也在藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第8號)之中,對應(yīng)的樣本醫(yī)院市場規(guī)模1.5億元。同在第一批自查中的江蘇天一時制藥和重慶華邦制藥的該品種已公告撤回。此外,北大醫(yī)藥的鹽酸莫西沙星片(CYHS1690001)進(jìn)入第四批自查即2016年11月4日自查清單,預(yù)計鹽酸莫西沙星片即將進(jìn)入仿制藥競爭時代。
抗艾滋病藥物
正大天晴的富馬酸替諾福韋二吡呋酯片(受理號CYHS1600082)以“抗艾滋病藥物”為由進(jìn)入優(yōu)先審評。正大天晴該產(chǎn)品也一度進(jìn)入第一批自查清單,并在公告2016年第21號中撤回;同情況的企業(yè)有珠海聯(lián)邦制藥中山分公司、安徽貝克生物和浙江南洋藥業(yè)。
同在第一批自查名單的成都倍特藥業(yè)歷經(jīng)了2016年第1號藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃,據(jù)悉已獲批生產(chǎn)。成都倍特2013年申報臨床的適應(yīng)癥包括慢性乙肝(用于成年患者和12歲以上兒童患者)和HIV-1感染(與其他抗逆轉(zhuǎn)錄病毒藥物聯(lián)合治療用于成年患者和2歲及以上兒童患者)。若成都倍特已批抗艾滋病藥的適應(yīng)癥,則正大天晴的富馬酸替諾福韋二吡呋酯片優(yōu)先審評的理由存疑。
重新申報的安徽貝克生物進(jìn)入了第三批自查即2016年9月1日自查清單中,同時進(jìn)入第三批自查的還有齊魯制藥,這兩家公司也要分別面臨第8號藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃和第7號藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃。
2015年以來,抗艾滋病藥獲得優(yōu)先審評審批資質(zhì)的相關(guān)產(chǎn)品有5個,第十二批優(yōu)先審評名單中除了富馬酸替諾福韋二吡呋酯片,還有江蘇艾迪申報的ACC007原料藥。ACC007是用于治療艾滋病毒的新型非核苷類逆轉(zhuǎn)錄酶抑制劑,據(jù)悉已在韓國已經(jīng)完成了健康志愿者第Ⅰ階段首次人體研究單次給藥劑量漸升法SAD和多次給藥劑量漸升法MAD臨床研究。
表1 抗艾滋病藥獲得優(yōu)先審評審批清單
(數(shù)據(jù)來源:咸達(dá)數(shù)據(jù)V3.2)
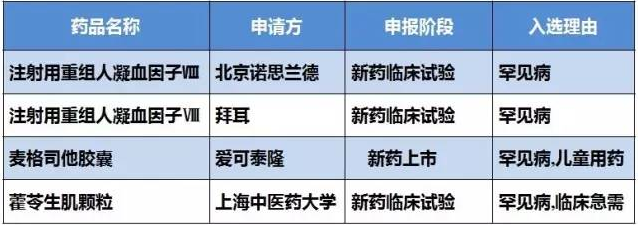
罕見病
北京諾思蘭德和拜耳醫(yī)藥保健有限公司注射用重組人凝血因子Ⅷ因“罕見病”理由獲得優(yōu)先審評,為第三個因為罕見病而有望優(yōu)先審評的產(chǎn)品,目標(biāo)適應(yīng)癥為A型血友病。
表2 罕見病獲得優(yōu)先審評審批清單
(數(shù)據(jù)來源:咸達(dá)數(shù)據(jù)V3.2)
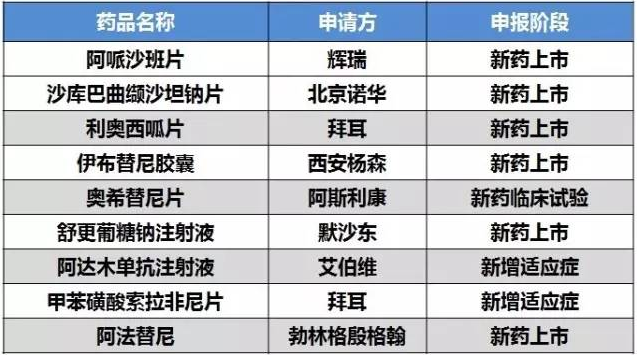
更具臨床優(yōu)勢
因更具臨床優(yōu)勢而獲得優(yōu)先審評的產(chǎn)品有9個,第十二批就占了4個,分別是輝瑞的阿哌沙班片、北京諾華的沙庫巴曲纈沙坦鈉片、拜耳的利奧西呱片和西安楊森的伊布替尼膠囊,都是申報生產(chǎn)。
國內(nèi)阿哌沙班片為百時美施貴寶上市,該藥為百時美施貴寶和輝瑞聯(lián)合開發(fā),國內(nèi)銷售權(quán)最近移交給輝瑞。輝瑞的本次申報預(yù)計會在“為接受擇期髖關(guān)節(jié)或膝關(guān)節(jié)置換術(shù)成年患者VTE的預(yù)防以及NVAF成年患者中風(fēng)和全身性栓塞的預(yù)防”的基礎(chǔ)上,增加減少初始治療后腿部深靜脈血液凝塊(即深靜脈血栓形成)和肺栓塞復(fù)發(fā)的適應(yīng)癥。
沙庫巴曲纈沙坦鈉片和利奧西呱片進(jìn)入了第三批自查清單。沙庫巴曲纈沙坦鈉片即LCZ696,為血管緊張素Ⅱ抑制劑纈沙坦和腦啡肽酶抑制劑AHU-377的復(fù)方組合,適應(yīng)癥為降低慢性心衰病人心臟病死亡和因心衰住院風(fēng)險。利奧西呱片2013年10月8日被FDA批準(zhǔn)用于治療肺動脈高壓。伊布替尼膠囊的適應(yīng)癥為治療新確診、復(fù)發(fā)或難治性慢性淋巴細(xì)胞白血病或小淋巴細(xì)胞淋巴瘤。
表3 更具臨床優(yōu)勢獲得優(yōu)先審評審批清單
(數(shù)據(jù)來源:咸達(dá)數(shù)據(jù)V3.2)
兒童藥
共14個產(chǎn)品由于兒童藥獲得優(yōu)先審評,第十二批獲得優(yōu)先審評的兒童藥為默沙東研發(fā)的口服五價重配輪狀病毒減毒活疫苗(Vero細(xì)胞)。近半年進(jìn)口疫苗已有2個獲批,2016年11月輝瑞十三價肺炎球菌結(jié)合疫苗獲批,也主要是用于兒童。葛蘭素史克的人類乳頭瘤病毒吸附疫苗則在2016年7月獲批。
表4 兒童用藥獲得優(yōu)先審評審批清單
(數(shù)據(jù)來源:咸達(dá)數(shù)據(jù)V3.2)









 相關(guān)新聞
相關(guān)新聞