藥物臨床試驗機構將要實行備案管理!
10月27日,CFDA辦公廳公開征求《藥物臨床試驗機構管理規定(征求意見稿)》意見(簡稱“征求意見稿”,下同)。根據“征求意見稿”,凡符合條件的醫療機構、醫學研究機構和醫藥高等學校及社會力量投資設立的臨床試驗機構均可備案;僅開展藥物臨床試驗相關的生物樣本等分析的臨床試驗機構,則不需要備案管理。
備案管理后,藥物臨床試驗機構需要自行或者聘請第三方對其藥物臨床試驗技術水平、設施條件及專業特點進行評估,并由第三方形成評估報告。
在中國境內開展以注冊為目的的藥物臨床試驗,以及開展藥物質量和療效一致性評價的生物等效性試驗,應當在藥物臨床試驗機構中進行。藥物臨床試驗機構未按照規定備案者,CFDA將不接受其完成藥物臨床試驗數據用于藥品上市許可,以及已上市藥品開展的質量和療效一致性評價。
臨床試驗機構資質改變:
五大亮點
相較2004年版《藥物臨床試驗機構資格認定辦法(試行)》,藥物臨床試驗機構應當具備的基本條件有以下改變:
一、更強調開展藥物臨床試驗的項目要與藥物臨床試驗機構的診療專業匹配。1)開展藥物臨床試驗的項目應當與醫療機構執業許可的診療科目相一致;2)具有與開展藥物臨床試驗相適應的診療技術能力;3)具有與藥物臨床試驗相適應的獨立的工作場所、臨床試驗用藥房、資料室,以及必要的設備設施;4)具有掌握藥物臨床試驗技術與相關法規,能承擔藥物臨床試驗的研究人員;5)開展藥物臨床試驗的專業具有與承擔藥物臨床試驗相適應的床位數和/或門急診量;6)具有與開展藥物臨床試驗相適應的醫技科室。其中第6條是新增的。
二、對主要研究者有職稱和經驗要求。主要研究者需具有高級職稱,參與過3個以上藥物臨床試驗。
三、新增要求“具有藥物臨床試驗倫理委員會”。倫理委員會負責審查藥物臨床試驗方案,審核和監督藥物臨床試驗研究者的資質,監督藥物臨床試驗開展情況并接受監管部門檢查。
四、新增要求“具有急危重病癥搶救的設施設備、人員與處置能力”,以保障患者權益;并且,對風險系數較大的新藥項目,提倡在三級機構展開臨床試驗研究。創新藥物首次在人體進行的試驗,或者臨床風險較高的臨床試驗,如窄治療窗藥物的試驗、可能引起心血管意外、感染等比較嚴重藥物相關不良事件后果的試驗,以及導致低血糖、低血壓、眩暈等需要臨床密切監測的試驗,應在三級醫療機構開展。
五、與臨床自查核查接軌,新增數據管理要求。具有藥物臨床試驗相關信息與數據管理系統,能確保試驗數據形成和處理過程完整、可溯源。
備案的藥物臨床試驗機構將在每年1月31日前通過備案平臺填報上一年度藥物臨床試驗(含倫理審查)整體情況。
此外,項目信息和接受境外藥監部門檢測的結果還要錄入備案平臺。備案的藥物臨床試驗機構在與注冊申請人簽署藥物臨床試驗合同后,應當在開展藥物臨床試驗第1例受試者入組前將項目信息錄入備案平臺。備案的藥物臨床試驗機構接到境外藥品監管部門檢查藥物臨床試驗要求的,應在接受檢查前將相關信息錄入備案平臺,并在接到檢查結果后3個工作日內將檢查結果信息按備案平臺要求錄入。
619家藥物臨床試驗機構:
廣東最多
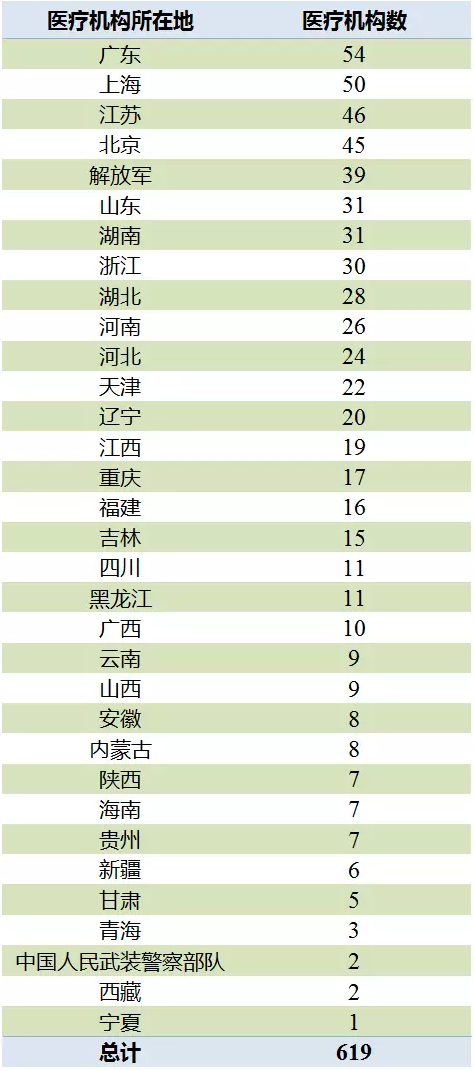
2017年10月,CFDA公布了經藥品監督管理部門會同衛生行政部門認定具有藥物臨床試驗機構資格的醫療機構619家,經認定的藥物臨床試驗機構均可以開展人體生物等效性試驗。其中廣東54家、上海50家和江蘇46家排名前列,北京的臨床試驗機構數未進入前三。
表1 具有藥物臨床試驗機構資格的醫療機構
(數據來源:咸達數據V3.2)
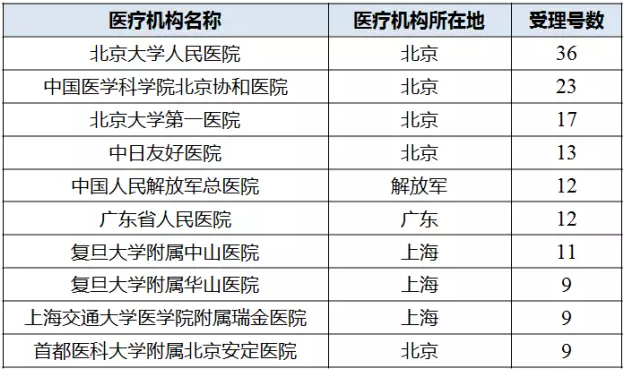
2015年臨床自查核查以來,進入臨床試驗數據現場核查計劃公告的產品都是企業對項目臨床試驗數據比較有信心的項目,以進口注冊為主。咸達數據V3.2整理15次藥物臨床試驗數據現場核查計劃公告的產品對應的臨床試驗組長單位發現,以受理號數從多到少排名,如表2所示,排名前四的醫療機構都是北京的。進口注冊更多是新藥,從項目所選擇的臨床機構可側面反映進口藥企更偏向選擇學科實力較強的臨床機構。
“征求意見稿”要求創新藥首次在人體進行的試驗,或者臨床風險較高的臨床試驗應在三級醫療機構開展,近期新藥項目以腫瘤藥為主,這意味著短期內三級腫瘤醫院有可能會出現項目扎堆。
表2 藥物臨床試驗數據現場核查計劃公告受理號數排名前十的臨床試驗組長單位
(數據來源:咸達數據V3.2)
Ⅰ期/BE臨床試驗機構選擇:
上海最熱
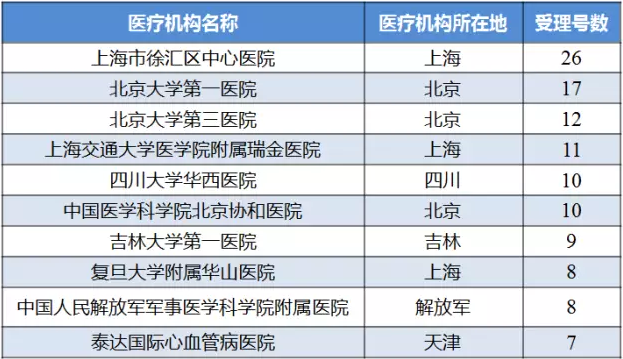
臨床試驗數據現場核查計劃公告中Ⅰ期/BE臨床試驗機構排名前十的醫療機構無一來自廣東。排名第一的是上海市徐匯區中心醫院,北京和上海的醫療機構都是熱門選擇。由此可見,項目方更看重的是臨床機構專業性、品牌、口碑、專家資源等因素,臨床機構數量即使放開,短時間內項目仍有可能扎堆于優質的臨床機構。表3中的中國人民解放軍軍事醫學科學院附屬醫院(即中國人民解放軍第三〇七醫院)并沒出現在619家可以開展人體生物等效性試驗的醫療機構名單中。
表3 藥物臨床試驗數據現場核查計劃公告受理號數排名前十的Ⅰ期/BE臨床試驗機構
(數據來源:咸達數據V3.2)
小結>>>
2017年版《藥品注冊管理辦法(修訂稿)》的征求意見稿顯示,我國即將進入臨床研究審批“寬進嚴出”的年代。CFDA對臨床試驗數據的真實性數據要求越來越高,藥品上市許可、已上市藥品開展的質量和療效一致性評價和注射劑再評價等項目,大多要求在國內開展臨床研究,潛在待開展的臨床試驗項目數較多,需要合規、專業的臨床試驗機構執行項目。藥物臨床試驗機構備案制有望緩解這一需求。
但是,從過往的數據顯示,企業更期望選擇專業性、品牌、口碑、專家資源等綜合因素較好的臨床試驗機構,這些臨床試驗機構短期內可能會出現項目扎堆。








 相關新聞
相關新聞