自2015年7月22日以來,自查批次已公布了七個批次,共2033個受理號進入臨床自查核查清單目錄以內。這七批自查核查清單中,進口藥品共387個。國內省份中,江蘇、北京、山東、廣東和浙江分別列前五位,受理號數都過100個。
自2016年優先審評制度實施以來,截至2017年5月21日,咸達數據V3.2發現,共212個受理號獲得優先審評,其中91個已進入臨床自查核查,43%的占比可見優先審評的加速力度。2016年臨床自查核查清單上的受理號14%是來自優先審評,2017年此比例上升到34%,由此可見第一批自查之后的幾批自查產品,更多的是與創新性、臨床需求掛鉤的項目。
表1 七批自查受理號數
(數據來源:咸達數據V3.2)
國產自查以仿制藥為主:石藥和天晴是2~7批自查產品數最多的企業
公告撤回基本上只有第一批臨床自查核查清單中有所公布。以企業為單位統計第二到七批臨床自查核查清單產品,石藥集團和正大天晴申報產品數并列第一多。這兩家的進入臨床核查自查清單的產品主要為仿制藥,特別是首仿藥或雙報藥為主。
石藥集團申報的有多潘立酮片、鹽酸二甲雙胍片、鹽酸莫西沙星片、注射用紫杉醇(白蛋白結合型)、鹽酸決奈達隆片和伊潘立酮片,目前只有鹽酸決奈達隆片進入藥物臨床試驗數據現場核查計劃公告(第5號)。
石藥鹽酸二甲雙胍片在美國ANDA已獲批。CFDA在2017年5月18日終于發布了仿制藥質量和療效一致性評價研制現場核查指導原則等4個指導原則的通告(2017年第77號),包括仿制藥質量和療效一致性評價的“研究現場核查指導原則” “生產現場檢查指導原則” “臨床試驗數據核查指導原則”和“評價有因檢查指導原則”,這意味著美國和中國雙報的產品有望加快獲批,石藥的鹽酸二甲雙胍片有望在2017年內上市。
正大天晴申報的有富馬酸替諾福韋二吡呋酯片、來那度胺膠囊、鹽酸安羅替尼膠囊、注射用福沙匹坦雙葡甲胺、注射用左泮托拉唑鈉和瑞舒伐他汀鈣片。
國內廠家自查申報也扎堆:氨氯地平熱度不減
國內廠家對仿制藥申報熱度也體現在第二到七批臨床自查核查清單產品中。苯磺酸氨氯地平片的國內廠家的生產批文數高達65個,但其依然是國內生產廠家申報最受歡迎的產品,共4家企業申報,分別是重慶藥友制藥有限責任公司、酒泉大得利制藥有限公司、北京永正制藥有限責任公司和河北東風藥業有限公司。目前只有重慶藥友制藥有限責任公司在藥物臨床試驗數據現場核查計劃公告(第7號)清單上。據悉,重慶藥友此項目是按一致性評價的質量標準申報的。
其次就是富馬酸替諾福韋二吡呋酯片,正大天晴藥業集團股份有限公司、齊魯制藥有限公司和安徽貝克生物制藥有限公司仍在等待第二家國內廠家上市的機會,三家都在藥物臨床試驗數據現場核查計劃公告中,按理應在2017年有審批結果。2016年成都倍特藥業有限公司上市該品種,當時獲批的適應癥為HIV-1感染,富馬酸替諾福韋二吡呋酯適用于與其他抗逆轉錄病毒藥物聯用治療成人HIV-1感染。
然而,總局關于鼓勵藥品醫療器械創新保護創新者權益的相關政策(征求意見稿)曾提到,“挑戰專利成功和境外已上市但境內首仿上市的藥品給予1.5年數據保護期,在數據保護期內,審評機構不再批準其他申請人同品種上市申請,申請人自行取得的數據除外”。成都倍特藥業有限公司首仿上市時間是2016年11月,富馬酸替諾福韋二吡呋酯片第二家是否就此順延到2018年6月上市,拭目以待。
2017年廣生堂富馬酸替諾福韋二吡呋酯膠囊獲批,從CDE臨床試驗可見,廣生堂的適應癥為用于治療慢性乙型肝炎的成年患者。福建廣生堂藥業股份有限公司共有2個受理號進入第一批臨床自查核查,舊化學藥分類5類申報的CXHS1300370在公告2015年第264號撤回,舊化學藥分類3.1類申報的CXHS1400157則沒有撤回且獲得優先審評。目前富馬酸替諾福韋二吡呋酯膠囊在申報的有成都倍特藥業有限公司。
鹽酸莫西沙星片同樣也是熱點,北大醫藥股份有限公司、石藥集團歐意藥業有限公司和南京新港醫藥有限公司在臨床自查核查清單之中,但尚無一進入藥物臨床試驗數據現場核查計劃公告。
進口藥上市又快又新:諾華沙庫巴曲纈沙坦鈉片(LCZ696)即將獲批
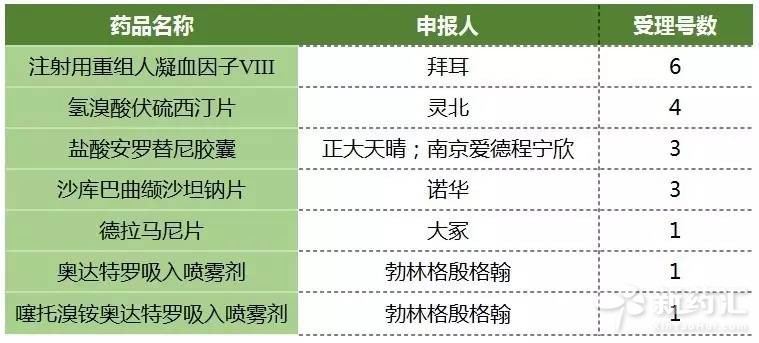
自總局2017年3月17日公開征求“關于調整進口藥品注冊管理有關事項的決定(征求意見稿)”意見以來,進口產品利好消息不斷。第七批自查中44個受理號數中就有35個受理號來自進口產品。第七批自查獲得優先審評資質的7個產品19個受理號只有鹽酸安羅替尼膠囊是國內生產廠家正大天晴藥業集團股份有限公司,其余都是進口產品。
7個優先審評的產品中,勃林格殷格翰(中國)投資有限公司的噻托溴銨奧達特羅吸入噴霧劑和拜耳醫藥保健有限公司的注射用重組人凝血因子Ⅷ申報的是臨床,其余都是申報上市,這意味著5個產品有望在2017年獲批。
正大天晴鹽酸安羅替尼膠囊目前已完成臨床適應癥有三線及以上晚期非小細胞肺癌,在研究的適應癥有晚期甲狀腺髓樣癌、晚期軟組織肉瘤、結直腸癌、晚期腎細胞癌、晚期胃癌、胃食管結合部腺癌和食管鱗癌。奧達特羅吸入噴霧劑適應癥為慢性阻塞性肺病(COPD)患者。德拉馬尼片治療多藥耐藥結核病。靈北抗抑郁藥氫溴酸伏硫西汀片用于重度抑郁癥(MDD)成人患者的治療。諾華的沙庫巴曲纈沙坦鈉片(LCZ696)臨床試驗已完成評價LCZ696用于原發性高血壓治療8周后的療效和安全性,以及降低慢性心力衰竭的發病率和死亡率的研究,預計適應癥為慢性心力衰竭。
表2 第七批自查優先審評產品
(數據來源:咸達數據V3.2)
焦點<<<
進口藥已經提速,
國產藥審批是否也能提速?
一般而言,進入臨床自查核查清單、進入臨床試驗數據現場核查計劃公告后才進入藥品審批流程,第二批自查名單至第七批自查名單國產廠家受理號數195個,優先審評僅12個,進入臨床試驗數據現場核查計劃公告25個;相比較而言,進口產品受理號216個,優先審評63個,進入臨床試驗數據現場核查計劃公告96個。
優先審評比較的是臨床需求和創新性,我國申報的主要仿制藥為主,國產藥品的優先審評數量較低是意料之中。但是,從進入臨床試驗數據現場核查計劃公告的進度來看,國產產品的審批進度低于進口產品。
不少進口藥企在抱怨2017年藥政不利過期原研藥,過期原研藥醫院市場丟標嚴重,2017年進口新藥的獲批或許可暫時緩解進口藥產品線青黃不接的困境。
國內生產廠家面臨同樣困境。不幸的是,許多廠家手里沒有符合改革新規要求的項目。被第一批自查核查耽誤沒上市且對項目質量有自信的仿制藥項目翹首以待更快的審批速度,2015年至今已兩年。“去”,或是“留”,亟需定錘之音。









 相關新聞
相關新聞