業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




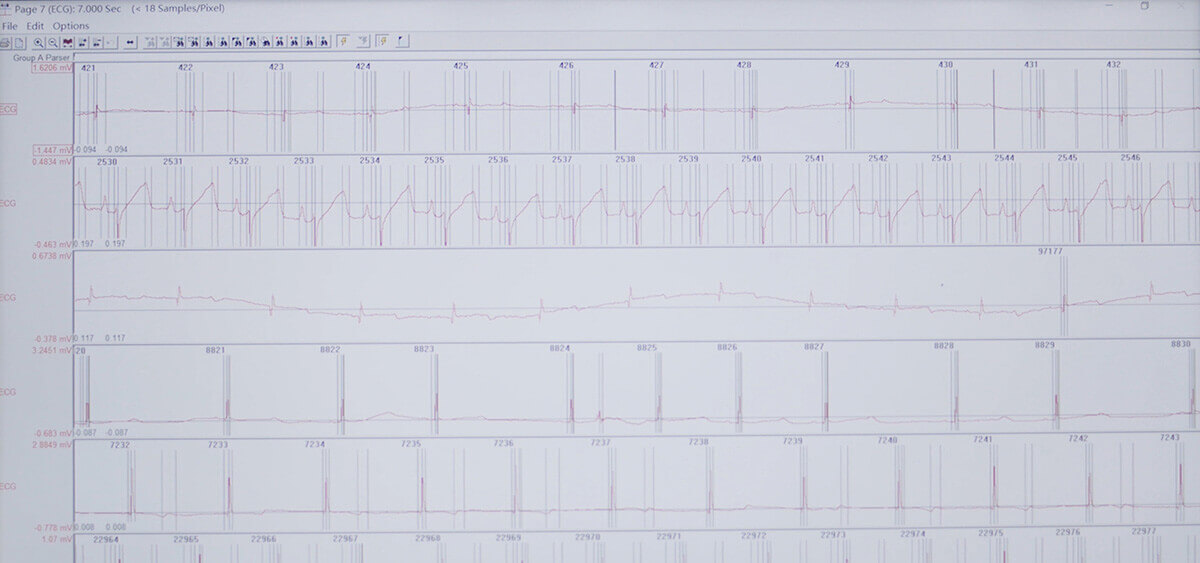
一般毒性試驗指給實驗動物進行不同途徑、不同期限的染毒,綜合檢測各種毒性終點的實驗。與一般毒性試驗容易混淆的是特殊毒性試驗,特殊毒性試驗指的是致突變、致癌、致畸的毒性試驗。
了解藥物對機體產生急性毒性的主要依據,是毒理學研究中最基礎的工作;
觀察藥物的毒性效應譜、毒作用特點和毒作用靶器官,了解藥物的毒性機制;
確認藥物毒性造成的損傷是否有可逆性;
研究重復接觸受試物毒性作用的劑量-反應(效應)關系,從初步了解到確定未觀察到有害作用的劑量(NOAEL)和其觀察到有害作用的最低劑量(LOAEL),為制定人類接觸的安全限量提供參考值;
確定不同動物物種對受試物的毒效應的差異,為將研究結果外推到人提供依據。
美迪西的一般毒性試驗包括急性毒性試驗、重復劑量毒性試驗(短期毒性試驗)、亞慢性毒性試驗和慢性毒性試驗。其中亞慢性毒性試驗和慢性毒性試驗也就是項目中常說的長期毒性試驗。
一般毒性試驗離不開實驗動物的貢獻,非臨床實驗動物的種屬分為嚙齒類(大鼠、小鼠、豚鼠、家兔)和非嚙齒類(狗、猴)。根據實驗動物選擇的基本原則,實驗動物最好滿足以下四點:毒性反應與人最接近、易于飼養和操作、自然壽命不太長、經濟并易于獲得。由于老鼠與人類的基因相似度高、且繁殖期短、環境適應力強,是非臨床實驗動物的首選。比較常見的實驗老鼠品種有:大鼠中的Sprague-Dawley(SD)和Wistar,小鼠中的昆明種(KM)、ICR(美國癌癥研究所,Institute of Cancer Research)、NIH、BALB/C。
美迪西擁有符合GLP標準的鼠房、犬房、猴房,能夠承接嚙齒類和非嚙齒類動物的非臨床一般毒性試驗,曾與美國MPI合作,學習并繼承了MPI的質量管理體系/SOP,實施全面的質量控制措施,采用三級QC管理方式,應用先進的數據管理軟件系統,項目經驗豐富。
最常用的染毒途徑為經口、經呼吸道、經皮膚和注射途徑。除了常見的PO、IV等給藥途徑。美迪西還建立了可以做噴霧劑藥物毒理試驗的吸入給藥平臺、眼科給藥平臺、皮膚給藥平臺、舌下給藥平臺、幼齡動物評價平臺、抗體、疫苗、ADC、CAR-T細胞治療等生物創新藥的整合評價技術平臺。

急性毒性是指實驗動物一次或24小時內多次接觸一定劑量試驗品,在短期內所產生的損害健康的作用和致死效應,觀察指標包括一般行為和外觀改變、大體形態變化以及死亡效應。如果試驗品的毒性低,一次最大染毒不足以充分了解急性毒性的作用,則會采用24小時內多次染毒的手段,染毒次數不超過3次,每次間隔至少4小時。急性毒性的觀察時間不同于給藥時間那樣短,一般為14天,如果有必要甚至可以延長至14天以上。
急性毒性試驗一般測定最大給藥量、最大無毒性反應劑量、最大耐受量、致死量等反應劑量,得到的結果有助于找到藥物的最佳使用濃度。近年來為了響應國際上保護試驗動物的號召,減少實驗動物可以避免的痛苦,提出了以“優化refinement、減少reduction、取代replacement”為中心思想的3R原則——急性毒性替代試驗,通過優化試驗方法或者用組織模型替代動物模型的方式來減少實驗動物的痛苦。
重復劑量毒性研究的主要目標是表征在指定時間內重復每日給藥或暴露于某種物質而發生的不良毒理學影響,直到測試物種的預期壽命(在動物研究中通常為 3 周至 2 年)。
重復給藥毒性試驗原則上至少應設低、中、高 3個劑量組,以及1個溶媒(或輔料)對照組,必要時設立空白對照組和/或陽性對照組;高劑量原則上使動物產生明顯的毒性反應,低劑量原則上相當或高于動物藥效劑量或臨床使用劑量的等效劑量,中劑量應結合毒性作用機制和特點在高劑量和低劑量之間設立,以考察毒性的劑量-反應關系。
亞慢性毒性是指實驗動物連續多日接觸較大劑量的外來化合物所出現的中毒效應。所謂較大劑量,是指小于急性LD50的劑量,試驗周期一般為90天。亞慢性毒性試驗的目的,主要是探討亞慢性毒性的閾劑量或閾濃度和在亞慢性試驗期間未觀察到毒效應的劑量水平,且為慢性試驗尋找接觸劑量及觀察指標。
亞慢性毒性其實遠比人們想象得要更加常見。舉幾個歷史上有名的例子:拿破侖在滑鐵盧戰敗后被放逐囚禁后死去,法醫發現他的頭發中坤含量超過正常人的13倍,原來囚禁房間里的墻壁用的是含砒霜的墻紙,一代梟雄拿破侖就這樣死于慢性坤中毒。在幾百年前,用來化妝美白的鉛粉也是導致大量貴族中毒死亡的元兇。
這是亞慢性毒性的蓄積作用(accumulation),當試驗品連續、反復被攝入,且吸收總量超過代謝總量時,毒性就會在體內逐漸增加,蓄積在血漿蛋白、脂肪組織、肝臟、腎臟、骨骼等器官內,長期危害身體健康,嚴重時甚至導致死亡。
美迪西的藥物安全性評價可以開展涵蓋多毒性終點的系統評價服務,并擁有國際認可的病理學研究支持我們的安全性評價研究。除研究試驗外,美迪西的臨床前藥理及毒理研究團隊配備有專業的SEND格式轉換團隊,建立了在軟件、技術、規范、素質等各方面全面成熟的SEND數據轉換平臺,實現精準地數據轉換,為電子數據的提交提供良好環境。僅2020年,就已幫助客戶完成了14項SEND數據轉換項目,其中3個新藥項目已經獲得了美國FDA的臨床許可。