COVID-19病毒在全球蔓延,事態(tài)不容樂觀,醫(yī)藥企業(yè)也將目光聚焦到抗病毒藥物的研發(fā)當(dāng)中。截至2月27日,共有249項(xiàng)與新型冠狀病毒相關(guān)的臨床試驗(yàn)登記注冊,有176個與治療相關(guān)的臨床試驗(yàn)正在進(jìn)行中,隨著病毒侵染范圍的擴(kuò)大,相信將會有更多的研究投入到抗病毒的研究中。
在抗病毒藥物的開發(fā)策略中,抗體和疫苗的研發(fā)是重要的開發(fā)策略。在3月5日,美迪西創(chuàng)始人&CEO陳春麟博士就這一課題展開了深入淺出的學(xué)術(shù)講解。
文章對陳博士的課題做了簡單回顧。點(diǎn)擊文末的“閱讀原文”,即可進(jìn)入視頻回放鏈接,觀看陳博士的精彩講解!
01 抗冠狀病毒抗體藥物靶點(diǎn)和技術(shù)
以往抗體研發(fā)的主要適應(yīng)癥為腫瘤和免疫性疾病,新冠肺炎后,抗體藥物也將重點(diǎn)關(guān)注在感染性疾病上的作用。
抗體療法是預(yù)防和治療感染性疾病的慣常做法。抗體在免疫系統(tǒng)中具有非常重要的角色。抗體可以直接和病毒結(jié)合,起到所謂中和作用,一旦被抗體結(jié)合做了標(biāo)記,病毒在體內(nèi)就會按照所形成的流程被消滅。
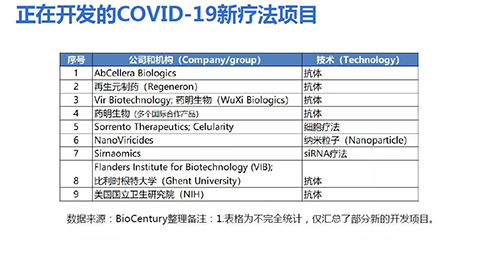
由于抗體制備時間長,目前針對COVID-19,全球有多家公司和研究機(jī)構(gòu)正在加快推進(jìn)抗體開發(fā),以應(yīng)對未來可能的再次爆發(fā)。現(xiàn)有近30個針對新冠病毒抗體藥物正在進(jìn)行臨床研發(fā)。
現(xiàn)已確立了7個抗冠狀病毒靶點(diǎn),同時也是藥物篩選靶點(diǎn)。包括:
(1)病毒配體Spike蛋白;
(2)病毒受體ACE2蛋白;
(3)病毒蛋白酶PLpro(papain-like protease);
(4)Mpro(3C-like protease,或main protease);
(5)介導(dǎo)病毒RNA帽子的甲基化修飾的nsp16;
(6)病毒轉(zhuǎn)錄復(fù)制相關(guān)的RdRp(RNA-dependent RNA polymerase;
(7)和潛在的病毒用于干擾宿主免疫的X domain蛋白。
另外新發(fā)現(xiàn)一個靶點(diǎn)絲氨酸蛋白酶TMPRSS2(Ⅱ型跨膜絲氨酸蛋白酶(TTSP)。新冠肺炎的靶點(diǎn)與抗癌藥比較相對較少。
抗體藥物經(jīng)歷40多年的發(fā)展,逐漸從雜交瘤、嵌合抗體,到人源化抗體等,技術(shù)逐漸成熟。
單克隆抗體藥物常用的單克隆抗體制備技術(shù)包括:

最早的淋巴細(xì)胞雜交瘤技術(shù)是通過向動物注射抗原、分離血清,得到中和抗體。現(xiàn)在演化為人源化細(xì)胞(如CHO)進(jìn)行基因重組,通過構(gòu)建載體、轉(zhuǎn)染、克隆、表達(dá)、建立穩(wěn)定性細(xì)胞株等系列工作,產(chǎn)生人源化抗體,較容易進(jìn)行工業(yè)化生產(chǎn)。
已有幾家公司可以進(jìn)行基于基因小鼠制備抗體(如上海和鉑醫(yī)藥、百奧賽圖等),技術(shù)比較成熟,生產(chǎn)速度快。
單細(xì)胞克隆抗體發(fā)現(xiàn)平臺如Abepic?,利用新型冠狀病毒感染的肺炎康復(fù)患者血樣,次日可獲得近百株新冠病毒全人源抗體。
02 抗病毒ADC的開發(fā)策略
然而由于抗體藥物單用效果不明顯,逐漸產(chǎn)生了新的抗體衍生物,如抗體藥物偶聯(lián)物(antibody-drug conjugate,ADC)。在國內(nèi)ADC藥物研發(fā)技術(shù)已相對成熟。ADC包括三個部分:抗體、小分子藥物、連接子。抗體到達(dá)靶細(xì)胞后,結(jié)合在細(xì)胞表面,攜帶的小分子進(jìn)入細(xì)胞,發(fā)揮雙重作用。
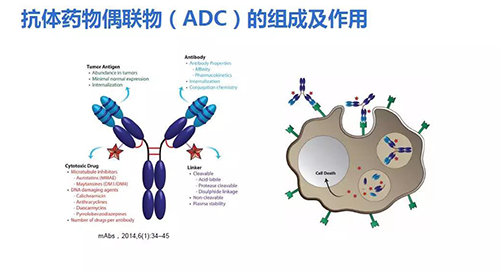
ADC經(jīng)歷以下發(fā)展歷程:(1)抗體藥物直接與小分子藥物連接;(2)第二代ADC通過連接子連接抗體和小分子藥物,但是為多聚物,大多數(shù)顯示出較窄的治療窗口;(3)第三代ADC呈現(xiàn)位點(diǎn)特異性偶聯(lián),藥物抗體為一比一。
ADC藥物適應(yīng)癥主要集中在抗腫瘤。抗病毒ADC藥物研發(fā)可選擇的小分子藥大概有以下十幾種。
抗病毒Payload組分列表
(1)5-取代的2‘-脫氧尿苷類似物 (如溴夫定)
(2)核苷類似物 (如恩替卡韋)
(3)焦磷酸鹽類似物 (如膦甲酸鈉)
(4)NRTI類藥物 (如拉米夫定)
(5)NNRTIs (如奈韋拉平)
(6)蛋白酶抑制劑 (如格佐匹韋)
(7)整合酶抑制劑 (如多替拉韋)
(8)進(jìn)入抑制劑 (如恩夫韋地)
(9)無環(huán)鳥苷類似物 (如更汐洛韋)
(10)無環(huán)核苷膦酸酯類似物 (如阿德福韋酯)
(11)HCV NS5A和NS5B抑制劑 (如索非布韋)
(12)流感病毒抑制劑 (如帕拉米韋)
(13)干擾素,免疫刺激劑,寡核苷酸和抗有絲分裂抑制劑
03 雙抗體/三抗體的的機(jī)會
單個抗體的治療效果有限,因此雙抗和三抗也是新藥研發(fā)很好的選擇,雙抗(雙特異性抗體)已經(jīng)在抗癌藥物領(lǐng)域成功應(yīng)用。雙抗通常由兩個不同的抗體分別與兩個抗原結(jié)合,因此效果一般要好于單個抗體。美國和歐盟都已經(jīng)有雙抗藥物獲得批準(zhǔn)上市,在中國雙抗藥物也已經(jīng)進(jìn)入臨床研究階段。
雙抗的結(jié)構(gòu)主要有兩大類,含F(xiàn)c片段(IgG-like雙特異性抗體)和不含F(xiàn)c片段(non-IgG-like雙特異性抗體)。雙抗能夠識別兩種不同的抗原和表位,阻斷兩種不同的信號通路發(fā)揮作用,因此兩個抗體能夠起到協(xié)同作用。雙抗比普通抗體增加一個特異性抗原結(jié)合位點(diǎn),通過介導(dǎo)免疫細(xì)胞對腫瘤的殺傷,雙靶點(diǎn)信號阻斷,具備更強(qiáng)的效果。
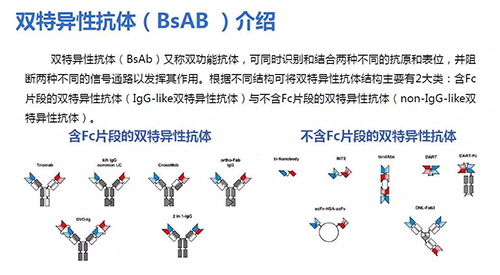
任意兩種抗原都可以交聯(lián)抗體變成雙抗進(jìn)行研究,因此組合數(shù)量很可觀。抗冠狀病毒有7個藥物靶點(diǎn),通過不同組合的變化,能夠得到很多不同的雙抗和三抗。這是雙抗體的未來發(fā)展趨勢。
04 抗體放射免疫偶聯(lián)藥物
除了攜帶小分子和雙抗體以外,利用抗體攜帶放射性免疫偶聯(lián)藥物(ARC)也是很好的研究方向。這項(xiàng)技術(shù)目前主要應(yīng)用于抗癌藥物領(lǐng)域,抗病毒領(lǐng)域尚沒有應(yīng)用,抗體放射性免疫偶聯(lián)藥物對比較頑強(qiáng)的病毒預(yù)計會有很好的效果。
抗體放射性免疫偶聯(lián)藥物常用的核素很多,最常用的131I,放射性核素在細(xì)胞中能夠發(fā)射連續(xù)性的輻射,引起細(xì)胞周期中放射性最敏感的 G2/M 期阻滯,阻止了靶細(xì)胞和附件細(xì)胞的DNA修復(fù),導(dǎo)致癌細(xì)胞和病毒細(xì)胞死亡。ARC是抗病毒領(lǐng)域新藥未來的發(fā)展方向。
05 抗體及其抗體衍生物的臨床前研發(fā)
抗體藥物的臨床前研發(fā)與小分子在很多方面存在差異,例如抗體的藥代動力學(xué)往往呈現(xiàn)非線性,組織穿透力更弱,結(jié)合位點(diǎn)包括清除率,通過蛋白質(zhì)水解進(jìn)行降解等。生物技術(shù)藥物臨床前研發(fā)往往面臨更多的挑戰(zhàn)與困難:
動物種屬的選擇,生物技術(shù)臨床前研究通常在嚙齒和非嚙齒兩個種屬進(jìn)行,比如食蟹猴和大鼠。即使嚙齒類不表達(dá)抗體或ADC的靶抗原而被認(rèn)為是非相關(guān)動物種屬時,用嚙齒類評估小分子脫靶毒性仍具有重要意義。評估多個不同抗體及ADC時我們觀察到大鼠在評估偶聯(lián)小分子脫靶毒性時與猴具有互補(bǔ)性。
抗體生物分析,抗體生物分析通常采用ELISA,ELISA的靈敏度高,但比小分子分析方法更加復(fù)雜,干擾因素很多,濃度與檢測信號是非線性關(guān)系,誤差大,需要非常小心使用。
臨床前安全性評價,生物技術(shù)藥物安全性評最重要的因素是選擇相關(guān)的動物種屬,通常非人靈長類是唯一的相關(guān)種屬,如果沒有相關(guān)種屬時,可選擇轉(zhuǎn)基因模型或者替代抗體。抗體或ADC安評價需要關(guān)注免疫原性研究,遺傳毒性和致癌試驗(yàn)一般不要求。
最后,越來越多的抗體廠家采用中美雙報的申報策略,符合兩國藥政法規(guī)的要求需要關(guān)注以下幾點(diǎn)。中國和美國都要求藥物安全性評價符合GLP規(guī)范, 但FDA建議采用集成軟件監(jiān)控全程的數(shù)據(jù)采集,具有認(rèn)定資格的病理學(xué)家閱片,中國尚沒有要求全程監(jiān)控,暫時沒有要求資格認(rèn)定的病理學(xué)家,有經(jīng)驗(yàn)的病理學(xué)家即可滿足中國要求。申報文件格式方面,美國申報資料要求毒理學(xué)試驗(yàn)轉(zhuǎn)換成SEND格式,SEND是FDA研究數(shù)據(jù)的一種標(biāo)準(zhǔn)格式,中國沒有要求SEND格式。
06 美迪西一站式臨床前研究平臺
美迪西經(jīng)過16年的穩(wěn)步發(fā)展,積累了豐富的對抗體及ADC等抗體衍生物的的研究和申報能力。美迪西目前擁有3個園區(qū)約30,000平方米的實(shí)驗(yàn)室面積,擴(kuò)建后將超過7萬平方米,擁有覆蓋多領(lǐng)域的科研攻堅團(tuán)隊(duì)。美迪西的一站式臨床前研究平臺包括了從藥物發(fā)現(xiàn)、藥學(xué)研究一直到臨床前研究、申報注冊的服務(wù)項(xiàng)目,涉及化學(xué)、生物、藥學(xué)、藥效學(xué)、藥代/毒代動力學(xué)、毒理學(xué)等多個學(xué)科。
經(jīng)年來,美迪西建立了多個實(shí)力強(qiáng)勁的技術(shù)平臺,包括蛋白質(zhì)/抗體藥物藥代動力學(xué)平臺,生物技術(shù)藥物非人靈長類安全評價平臺,基于動物模型的藥效學(xué)平臺等等,都為抗體及抗體衍生物新藥研究提供了強(qiáng)有力的工具和手段。
除此之外,美迪西已達(dá)到全球多個國家的安全性評價平臺標(biāo)準(zhǔn),在美國、澳大利亞、歐洲等地助力多個項(xiàng)目獲得臨床批件,為國際申報積累了豐富的案例經(jīng)驗(yàn)。
THE END
關(guān)于美迪西
美迪西(股票代碼:688202)是一家藥物研發(fā)外包服務(wù)公司(CRO)。成立于2004年2月2日,公司走過16個年頭,在上海建立了一家集化合物合成、化合物活性篩選、結(jié)構(gòu)生物學(xué)、藥效學(xué)評價、藥代動力學(xué)評價、毒理學(xué)評價、制劑研究和新藥注冊為一體的符合國際標(biāo)準(zhǔn)的綜合技術(shù)服務(wù)平臺,并得到了國際藥品管理部門的認(rèn)可。美迪西普亞的動物實(shí)驗(yàn)設(shè)施獲得AAALAC(國際動物評估與認(rèn)證協(xié)會)認(rèn)證和國家藥品監(jiān)督管理局NMPA GLP證書,并已達(dá)到美國食品藥品管理局GLP標(biāo)準(zhǔn)。
美迪西擁有豐富的全球合作經(jīng)驗(yàn),2015年以來,美迪西在全球服務(wù)超過500家活躍客戶,已為武田制藥、強(qiáng)生制藥、葛蘭素史克、羅氏制藥等多家全球性制藥公司及恒瑞醫(yī)藥、揚(yáng)子江藥業(yè)、石藥集團(tuán)、華海藥業(yè)、眾生藥業(yè)等國內(nèi)外知名客戶提供研發(fā)外包服務(wù)。
聯(lián)系我們
Email: marketing@medicilon.com.cn
電話: +86 (21) 5859-1500(總機(jī))
點(diǎn)這里“
閱讀原文”,查看全部視頻回放!











 相關(guān)新聞
相關(guān)新聞