



業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請(qǐng)撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




新藥研發(fā)中,工藝質(zhì)量標(biāo)準(zhǔn)在IND階段的建立扮演著至關(guān)重要的角色。這些標(biāo)準(zhǔn)不僅僅是規(guī)定,更是保障藥物品質(zhì)的基石,對(duì)整個(gè)研發(fā)過程有著深遠(yuǎn)的影響。工藝質(zhì)量標(biāo)準(zhǔn)的確立能夠確保生產(chǎn)的一致性,降低生產(chǎn)風(fēng)險(xiǎn),確保未來產(chǎn)品質(zhì)量的穩(wěn)定性,也為臨床試驗(yàn)的的可靠性奠定基礎(chǔ);
美迪西云講堂CMC專題直播第三期,特別邀請(qǐng)了在藥物分析領(lǐng)域擁有豐富經(jīng)驗(yàn)的王貴芳老師做客云講堂,對(duì)于IND階段質(zhì)量標(biāo)準(zhǔn)有什么難題和困惑,讓我們一起聽聽王老師的解惑時(shí)間!
歡迎點(diǎn)擊鏈接“http://www.2tiens.com/video/process-quality-standards.shtml”,觀看直播回顧王老師的整場(chǎng)分享。
問:什么情況下需要加入熔點(diǎn)檢測(cè)項(xiàng)呢?
答:熔點(diǎn)檢測(cè)項(xiàng)是反應(yīng)原料藥物理性質(zhì)以及純度的檢測(cè)項(xiàng),常規(guī)情況下都會(huì)定入。但如果熔融的時(shí)候同時(shí)分解或者碳化,那么熔點(diǎn)可能會(huì)檢測(cè)不到,這是沒有意義的。那么在經(jīng)過研究以后,我們就不會(huì)訂入質(zhì)量標(biāo)準(zhǔn)了。因此,一般情況下我們首先要對(duì)它進(jìn)行研究,如果能找到合適的方法,是需要把熔點(diǎn)定入質(zhì)量標(biāo)準(zhǔn)中。
問:怎么確定原料藥哪些研究項(xiàng)目需要訂入質(zhì)量標(biāo)準(zhǔn)?
答:可以回看直播中檢測(cè)項(xiàng)的具體介紹。具體需要看原料藥的性質(zhì),比如是注射劑還是口服制劑,選擇對(duì)應(yīng)的檢測(cè)項(xiàng)。比如旋光度是手性中心藥物需考察項(xiàng)。如果是特殊原料藥需要額外考察一些性狀。除此之外,都盡量訂入質(zhì)量標(biāo)準(zhǔn)中,除非是類似之前的問題提到的,研究后發(fā)現(xiàn)熔融的時(shí)候同時(shí)分解碳化,那么就不適合放入標(biāo)準(zhǔn)中。

因此研究思路就首先把這些檢測(cè)項(xiàng)都找出來,然后對(duì)它進(jìn)行研究,研究后將合適的訂入標(biāo)準(zhǔn),這樣才能保證檢測(cè)項(xiàng)比較全面。
問:雜質(zhì)譜需要被毒理批次覆蓋是什么意思?
答:雜質(zhì)譜是雜質(zhì)的種類,比如GMP批次的樣品里面有雜質(zhì)01,雜質(zhì)02,雜質(zhì)03,以及特定雜質(zhì)RRT0.32, 這四個(gè)雜質(zhì)。那最好毒理批次中也有雜質(zhì)01,雜質(zhì)02,雜質(zhì)03,以及特定雜質(zhì)RRT0.32,這樣就是雜質(zhì)譜一致,GMP批次雜質(zhì)譜是被毒理批次覆蓋的。
另外,我們通常指的被覆蓋也會(huì)指它的雜質(zhì)水平,就比方說GMP批次有雜質(zhì)01,雜質(zhì)02,雜質(zhì)03以及特定雜質(zhì)RRT 0.32,當(dāng)GMP批次的雜質(zhì)小于毒理批次中的這幾個(gè)雜質(zhì)水平,就可以稱之為被覆蓋了。
問:多大的雜質(zhì)會(huì)確定結(jié)構(gòu)去預(yù)測(cè)基毒,還是預(yù)測(cè)基毒從已知雜質(zhì)去預(yù)測(cè)就行?
答:預(yù)測(cè)基毒和雜質(zhì)水平?jīng)]有太大的關(guān)系,如果是一類或二類雜質(zhì),可能含量很低就會(huì)影響藥物的安全性。當(dāng)前有關(guān)物質(zhì)的方法,檢測(cè)結(jié)果未檢出,只是基于當(dāng)前方法的靈敏度的結(jié)果。尤其是對(duì)非癌癥類藥物,對(duì)申報(bào)路線里有的起始物料,中間體,以及已知結(jié)構(gòu)的雜質(zhì),我們都會(huì)去進(jìn)行預(yù)測(cè)。如果是未知雜質(zhì)的話,是無法預(yù)測(cè)的。因?yàn)檐浖A(yù)測(cè)的前提是需要目標(biāo)化合物結(jié)構(gòu),把結(jié)構(gòu)輸入到對(duì)應(yīng)的軟件中,會(huì)得到目標(biāo)結(jié)構(gòu)的模擬報(bào)告。
問:后期對(duì)于以RRT形式報(bào)告的雜志如何進(jìn)行準(zhǔn)確歸屬?萬一由于不同儀器導(dǎo)致RRT值改變了呢?
答:在I期申報(bào)過程中,我們的方法的耐用性考察相對(duì)較少。因此,我們以RRT形式報(bào)告的雜質(zhì),有時(shí)候確定歸屬確實(shí)是一項(xiàng)挑戰(zhàn)。但我們有毒理批次,當(dāng)歸屬問題困擾時(shí),可以將毒理批次作為對(duì)照批次,這樣就能避免歸屬不準(zhǔn)確的可能性。
儀器的差異,在同一序列,對(duì)不同批次樣品的影響是一致的。因此,使用毒理批次的樣品作為對(duì)照能夠有效防止歸屬錯(cuò)誤。
問:仿制藥項(xiàng)目藥典中提到重金屬,現(xiàn)在我們新增元素雜質(zhì)檢項(xiàng),重金屬還需要做嗎?
答:仿制藥申報(bào)時(shí)比較看重已有標(biāo)準(zhǔn),比如各國的藥典。藥典中有的檢測(cè)項(xiàng),建議保留。我們?cè)谧龊芏喾轮扑幍纳陥?bào)項(xiàng)目時(shí),我們尊重原有的藥典標(biāo)準(zhǔn),保留重金屬檢測(cè)項(xiàng)的同時(shí),也會(huì)根據(jù)ICH Q3D進(jìn)行元素雜質(zhì)的研究。以確保仿制藥在變數(shù)雜質(zhì)水平上是安全的。
問:GMP 0.3%的雜質(zhì)需要做動(dòng)物實(shí)驗(yàn)嗎?
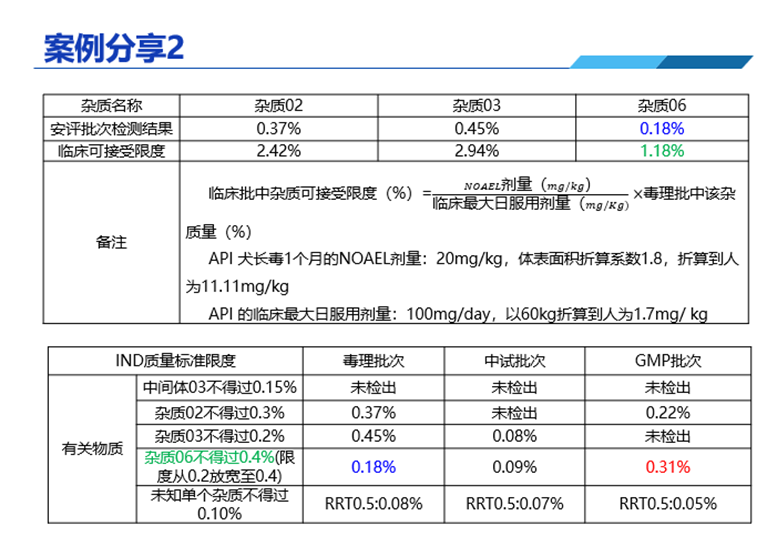
答:在直播中分享的案例中(如下圖),這個(gè)案例當(dāng)時(shí)沒有單獨(dú)拿GMP批次樣品再次做動(dòng)物實(shí)驗(yàn)。因?yàn)槎纠砼我呀?jīng)完成了動(dòng)物實(shí)驗(yàn),雖然在安全性實(shí)驗(yàn)中,雜質(zhì)含量只有0.18%,我們按照毒理批次雜質(zhì)的含量,結(jié)合動(dòng)物實(shí)驗(yàn)NOAEL值去計(jì)算臨床批可接受限度大于0.3%,所以GMP產(chǎn)品是安全的,就不需要再單獨(dú)拿GMP批次進(jìn)行動(dòng)物實(shí)驗(yàn)了。
問:重金屬限度研究要在哪個(gè)階段開始?
答:在一開始定質(zhì)量標(biāo)準(zhǔn)檢測(cè)時(shí),就定入。有代表批次樣品時(shí),如小試批次時(shí),就可以開始研究檢測(cè)。
關(guān)于新藥研發(fā)的質(zhì)量學(xué)研究方面,您還有什么困惑和感興趣的話題嗎?歡迎留言評(píng)論。
美迪西分析測(cè)試服務(wù)中心位于美迪西南匯園區(qū),實(shí)驗(yàn)室總面積達(dá)2800+平方米,GMP體系多次通過NMPA現(xiàn)場(chǎng)核查,并積極推進(jìn)CNAS認(rèn)證。
目前,美迪西分析測(cè)試服務(wù)中心搭建了基因毒性研究、理化表征研究、微生物研究、雜質(zhì)制備及結(jié)構(gòu)鑒定、痕量雜質(zhì)殘留溶劑分析、痕量雜質(zhì)元素雜質(zhì)分析、安全評(píng)估試驗(yàn)、分析方法開發(fā)及質(zhì)量監(jiān)控等服務(wù)平臺(tái),可為客戶提供一體化的藥物分析解決方案和技術(shù)服務(wù),包括常規(guī)理化檢測(cè)項(xiàng)目、特殊檢測(cè)項(xiàng)目、色譜檢測(cè)項(xiàng)目等,支持新藥開發(fā)、藥品CMC申報(bào)以及生產(chǎn)放行等,助力新藥上市及國際化進(jìn)程。
 相關(guān)新聞
相關(guān)新聞時(shí)間:2020年04月09日 20:00-21:00
地點(diǎn):線上直播
時(shí)間:2022年05月19日19:00
地點(diǎn):線上直播