美迪西疼痛疾病藥效評價模型
美迪西疼痛疾病藥效評價模型- 鎮痛藥效評價模型旨在模擬不同的臨床疾病,研究其潛在機制和治療方法,并測量能夠評估疼痛體驗的多個環節,包括反射性痛覺過敏測量、疼痛的感覺和情感維度以及疼痛對功能和生活質量的影響等。
熱板試驗
熱板試驗是一種廣泛用于嚙齒動物痛覺評估的試驗方法。將嚙齒動物放在一個用玻璃容器封閉的熱板上,記錄它們做出反應(如發聲、舔爪子或舉起爪子,多采用舔足作為痛反應指標)所需的時間,即得出對熱相關疼痛作出反應的潛伏期。熱板反應有高位中樞參與,該試驗的優點是客觀、可量化、可重復進行且不會引起炎癥,能夠深入了解疼痛反應和疼痛耐受性的程度,適合評估小鼠肢體運動的反饋,上皮層組織對有害刺激的反應等。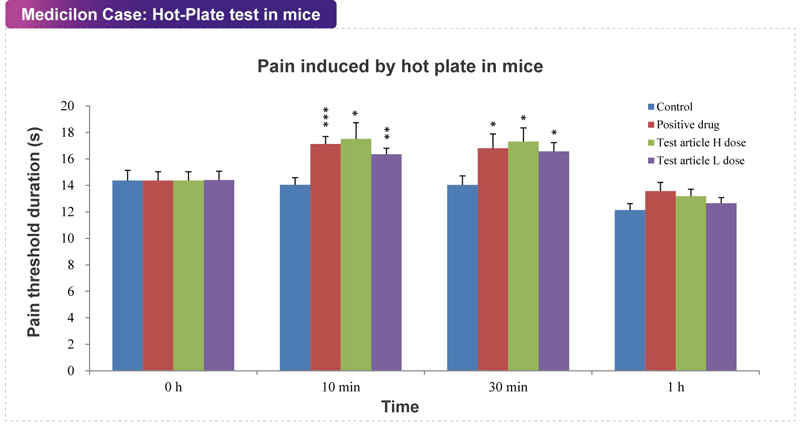 美迪西案例:熱板試驗
美迪西案例:熱板試驗醋酸扭體試驗
扭體試驗是一種通過化學刺激誘發急性炎癥性疼痛的方法。向小鼠腹腔注射刺激性物質(如苯醌、緩激肽、乙酸等)誘發疼痛,觀察并記錄實驗動物的扭體反應,來評估外周鎮痛藥物的療效(Koster et al., 1959)。該方法操作簡便、敏感、重復性好,常用于評價中樞和外周鎮痛藥物。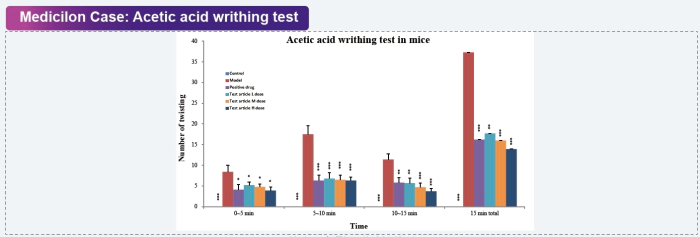 美迪西案例:醋酸扭體試驗
美迪西案例:醋酸扭體試驗福爾馬林致痛模型
福爾馬林試驗被廣泛應用于研究化學刺激誘發急性和持續性疼痛。嚙齒動物的福爾馬林試驗是一種有效可靠的痛覺模型,對各類鎮痛藥物都很敏感。在嚙齒動物后爪經皮下注射福爾馬林溶液,誘發與濃度成正比的疼痛反應,可表現為兩個時相。? I相:在注射福爾馬林后立即發生急性反應,直接激活了初級傳入感覺神經元,可持續約5~10分鐘。I相疼痛主要是刺激C纖維所致,非甾體類抗炎藥對其沒有作用;? II相:能夠反映傳入背角內中樞神經系統神經元敏化的綜合效應,可在注射后的10~60分鐘左右持續發生。II相疼痛反應有炎癥機制參與,神經性鎮痛藥和非甾體抗炎藥對該階段疼痛反應都有鎮痛作用。與其他模型相比,福爾馬林模型實驗具有以下優勢:福爾馬林注射后立即引起C纖維自發活動劇增,經快速傳遞致脊髓投射神經元,繼以第二相傳入爆發,反應為廣泛背角神經元激活,引發疼痛。該刺激可持續誘導動物產生痛覺行為,而非在不受約束的動物身上產生瞬時痛覺行為,可以更精確地評估鎮痛劑的起效時間和持續時間,還可以區分中樞性鎮痛劑和炎癥性鎮痛劑。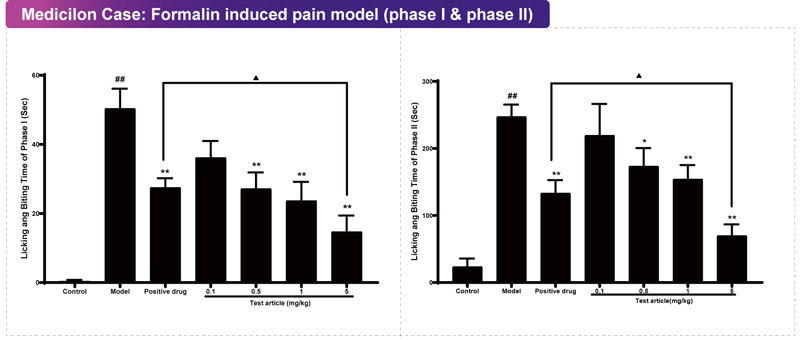 美迪西案例:福爾馬林致痛模型
美迪西案例:福爾馬林致痛模型完全弗氏佐劑致痛模型
完全弗氏佐劑(Complete Freund's Adjuvant, CFA)是一種細菌抗原乳化劑,可誘導細胞介導的免疫應答,促進免疫球蛋白的產生,引起注射部位的組織炎癥和細胞因子釋放。CFA能模擬類風濕性關節炎等炎癥性病變,且在大鼠和小鼠中均具有很高的重現性。CFA含有脂蛋白、糖脂和肽聚糖,可被抗原呈遞細胞通過模式識別受體識別。CFA可誘導外周和中樞的痛覺神經元的敏化,從而導致疼痛癥狀。例如對熱刺激和機械刺激的痛覺過敏和異動癥。CFA誘導的外周炎癥性疼痛模型會產生一種持續性炎癥狀態,可用于研究慢性炎癥性疼痛的潛在機制。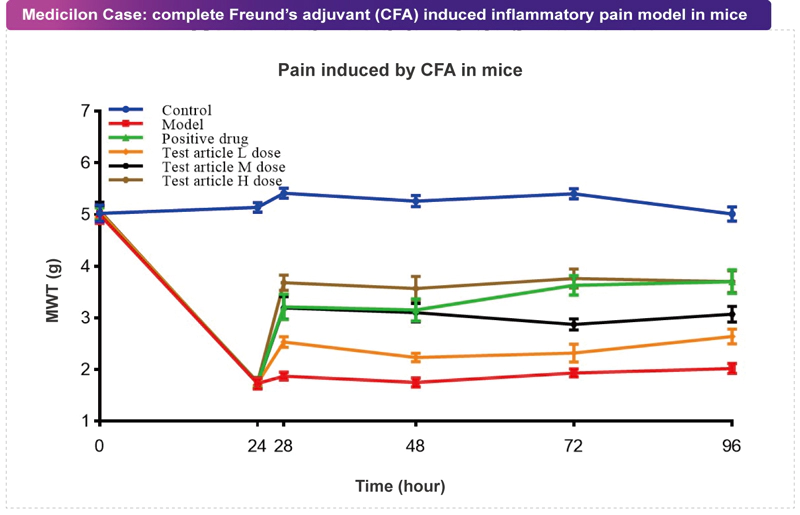 美迪西案例:CFA致痛模型
美迪西案例:CFA致痛模型膠原誘導的關節炎模型
類風濕性關節炎(Rheumatoid Arthritis, RA)是最常見的慢性炎癥性疾病之一,特征是慢性關節炎癥、滑膜肥厚、軟骨和骨質逐漸破壞,導致關節疼痛甚至嚴重殘疾。臨床癥狀包括關節疼痛和活動困難,對患者的生活和工作造成負面影響,并引發心理問題。RA的動物模型對于研究體內發病機制和確定抗RA藥物的療效至關重要。在過去幾十年中,許多嚙齒類動物關節炎模型已被評估為潛在抗RA藥物評價的模型,建模方法也相對成熟。其中,膠原誘導的關節炎(Collagen Induced Arthritis, CIA)和RA在臨床前、病理學和免疫學等方面的相似性,使其成為研究和應用最廣泛的標準模型。在CIA模型中,關節炎的發展和嚴重程度通過基于外周關節腫脹和發紅的臨床評分系統來評估,其疼痛反應也是其主要癥狀之一。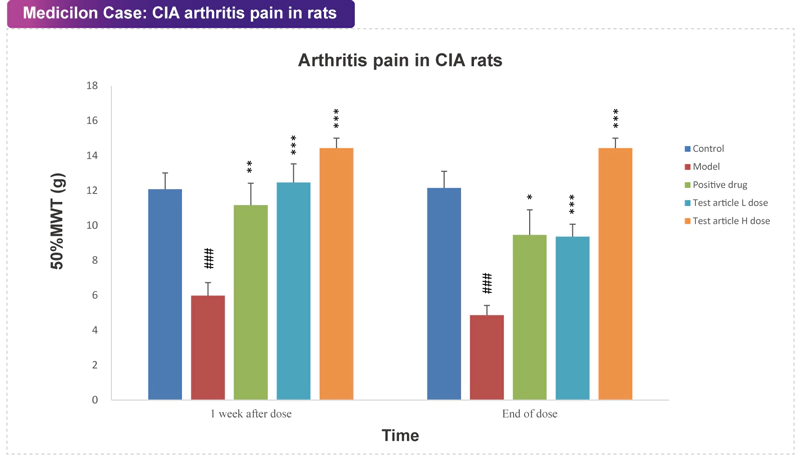 美迪西案例:CIA關節炎疼痛模型
美迪西案例:CIA關節炎疼痛模型坐骨神經分支選擇性損傷模型
周圍神經病理性疼痛是一種嚴重的慢性疼痛,致病因素多樣,在不同部位、不同時間、不同疾病狀態下表現出多種不同的機制。坐骨神經分支選擇性損傷(Sciatic Nerve Injury, SNI)模型是在嚙齒類動物的坐骨神經高處結扎,模擬外周神經病理性疼痛的癥狀,評估作用于外周神經痛的鎮痛藥物。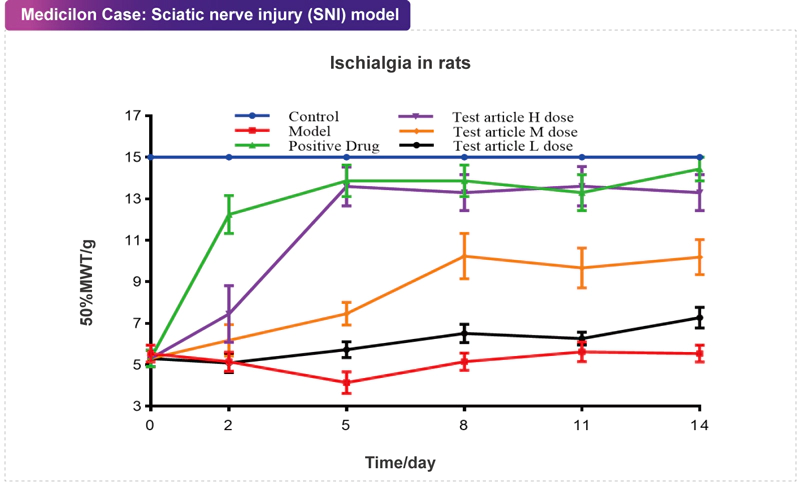 美迪西案例:坐骨神經分支選擇性損傷(SNI)模型
美迪西案例:坐骨神經分支選擇性損傷(SNI)模型手術切口疼痛模型
術后疼痛(Postoperative Pain, POP)是一種急性傷害性疼痛。這種短暫但強烈的疼痛不僅會嚴重削弱患者的行動能力并延緩康復,如未能及時控制,還可能發展為術后慢性疼痛(Chronic Post-surgical Pain, CPSP),其性質也可能轉變為神經病理性疼痛或混合性疼痛。阿片類藥物是目前針對POP的主要治療手段,但鑒于其成癮性,急需更多非阿片類疼痛治療藥物進入臨床。為了開發治療POP的最佳療法并降低CPSP的嚴重程度和/或發生率,必須明確其疾病機制。在臨床前研究階段,POP的黃金標準是足底切口模型(Brennan et al.,1996),并通過Von Frey法測試切口術后的痛覺行為。大鼠和小鼠急性切口痛模型均可應用于研究導致術后疼痛的分子、細胞和生理機制,并為其新藥的研發提供可靠的評價方法。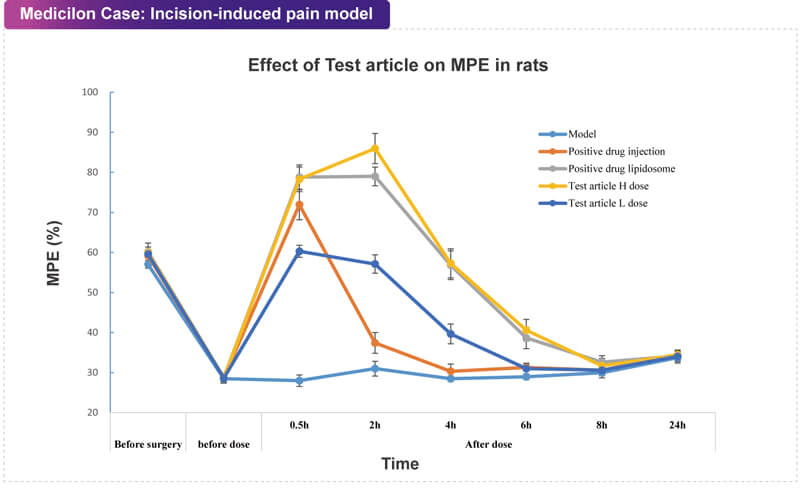 美迪西案例:切口疼痛模型
美迪西案例:切口疼痛模型糖尿病神經痛模型
糖尿病是一種以高血糖為特征的代謝性疾病,糖尿病周圍神經病變(Diabetic Peripheral Neuropathy, DPN)則是糖尿病最常見的慢性并發癥之一。DPN的特征是周圍神經從遠端到近端逐漸退化,從而導致感覺癥狀的異常,包括疼痛、虛弱和/或感覺喪失。建立合適的體內研究模型對于研究DPN病理機制和開發新的治療策略至關重要。·在嚙齒類動物中建立糖尿病神經病變模型的三種主要策略為:化學誘導、營養誘導和遺傳修飾。目前,部分糖尿病大鼠和小鼠模型能夠觀察到與DPN相關的神經損傷。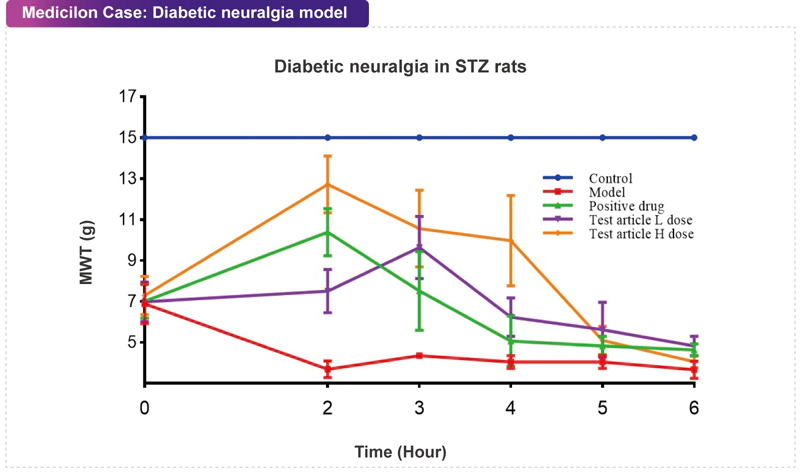 美迪西案例:糖尿病神經痛模型
美迪西案例:糖尿病神經痛模型化療痛模型
化療誘導的周圍神經病變(Chemotherapy-induced Painful Neuropathy, CIPN)是常見且嚴重的臨床問題,其程度及預后與單次和累積藥物劑量有關,常見于使用化療藥物治療后(如鉑類藥物、長春堿類、紫杉醇類、沙利度胺、蛋白酶體抑制劑和表蒽醌類藥物)。周圍神經病理性疼痛是主要副作用之一,可出現麻木、刺痛、持續/自發疼痛、對機械和/或冷刺激過敏等癥狀。通過重復注射化療藥物(包括紫杉醇、長春新堿等),可以在嚙齒動物身上再現類似于人類化療造成的疼痛行為,從而建立CIPN的嚙齒動物模型。誘導的神經病變表現為較低的機械痛閾值、冷敏感性以及協調性和平衡能力下降。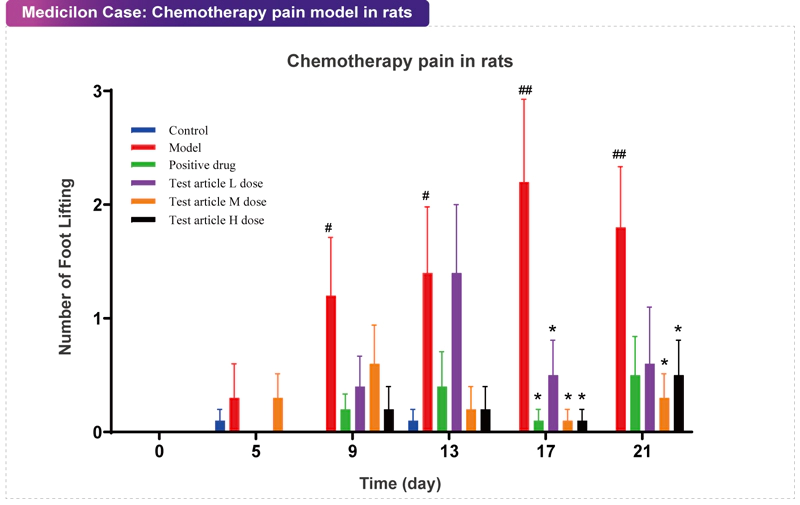 美迪西案例:化療痛模型
美迪西案例:化療痛模型
 更多“鎮痛藥物研發“相關內容推薦
更多“鎮痛藥物研發“相關內容推薦- 助力
國內首款長效鎮痛新藥!美迪西祝賀清普生物美洛昔康注射液(Ⅱ)中美兩地獲批上市
美洛昔康注射液(Ⅱ)是一種靜脈注射用非甾體類抗炎藥(NSAID),主要用于成人術后鎮痛管理。這是國內首款長效NSAID注射劑,單次注射可實現24小時持續強效鎮痛。
美迪西為美洛昔康注射液(Ⅱ)提供了部分關鍵臨床前研發服務,為其快速獲批上市奠定基礎。
助力2024年,南京綠葉制藥有限公司自主研發的LY09607順利獲得臨床試驗許可,擬用于術后鎮痛。
美迪西為LY09607的研發提供了藥代動力學和GLP安全性評價研究服務,為藥物的順利獲批奠定了堅實基礎。
平臺美迪西藥效部構建了涵蓋眾多精神系統疾病模型評價技術:
? 抗抑郁藥
? 抗老年癡呆癥藥
? 鎮靜催眠抗焦慮藥
? 鎮痛藥
? 抗驚厥藥
? 抗帕金森癥藥
? 抗精神分裂癥藥可以從分子水平、細胞水平、Ex vivo、In vivo等多層面全面評價一類創新藥物。
- 參考文獻:[1] Adriana Domínguez-Oliva, et al. The neurobiology of pain and facial movements in rodents: Clinical applications and current research. Front Vet Sci. 2022 Sep 29:9:1016720. doi: 10.3389/fvets.2022.1016720.
[2] Amanda Gunn, et al. The influence of non-nociceptive factors on hot-plate latency in rats. J Pain. 2011 Feb;12(2):222-7. doi: 10.1016/j.jpain.2010.06.011.
[3] Colleen R McNamara, et al. TRPA1 mediates formalin-induced pain. Proc Natl Acad Sci U S A. 2007 Aug 14;104(33):13525-30. doi: 10.1073/pnas.0705924104.
[4] Carlos Minoru Omura, et al. Decrease of IL-1β and TNF in the Spinal Cord Mediates Analgesia Produced by Ankle Joint Mobilization in Complete Freund Adjuvant-Induced Inflammation Mice Model. Front Physiol. 2022 Jan 14:12:816624. doi: 10.3389/fphys. 2021.816624.
[5] Anne-Laure Mausset-Bonnefont, et al. Arthritis sensory and motor scale: predicting functional deficits from the clinical score in collagen-induced arthritis. Arthritis Res Ther. 2019 Dec 4;21(1):264. doi: 10.1186/s13075-019-2047-z.
[6] Ashley M Cowie, et al. A Mouse Model of Postoperative Pain. Bio Protoc. 2019 Jan 20;9(2): e3140. doi: 10.21769/BioProtoc.3140.
[7] Phillipe D O'Brien, et al. Mouse models of diabetic neuropathy. ILAR J. 2014;54(3):259-72. doi: 10.1093/ilar/ilt052.
[8] Holly L Hopkins, et al. Chemotherapy-induced painful neuropathy: pain-like behaviours in rodent models and their response to commonly used analgesics. Curr Opin Support Palliat Care. 2016 Jun;10(2):119-128. doi: 10.1097/SPC.0000000000000204.