



業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




阿爾茨海默病(Alzheimer's disease, AD)是一種嚴(yán)重的進行性神經(jīng)退行性疾病,具有較長的前期癥狀、早期診斷困難,臨床特征為認知障礙、精神行為問題和社會及生活功能喪失,最終導(dǎo)致死亡。目前,AD患者可用的治療藥物非常有限,主要分為膽堿酯酶抑制劑、谷氨酸受體拮抗劑、及新近批準(zhǔn)的Aβ單抗藥物等。
美迪西建立了一站式臨床前生物醫(yī)藥研發(fā)服務(wù)平臺,為阿爾茨海默病藥物的開發(fā)提供藥物發(fā)現(xiàn)、藥學(xué)研究、及臨床前研究服務(wù)(包括藥效、藥代、安評)以及IND申報等一站式服務(wù)。
在美國,據(jù)估計目前有690萬65歲及以上的人患有阿爾茨海默病[1]。預(yù)計到2060年,該患病率將翻倍,可能會增長到1380萬以上,造成重大的社會和經(jīng)濟負擔(dān)。阿爾茨海默病患者的比例隨著年齡的增長而增,5.0%的65歲至74歲的人、13.2%的75歲至84歲的人、33.4%的85歲及以上的人患有阿爾茨海默病。阿爾茨海默病是65歲及以上美國人死亡的第五大原因,在2000年至2021年期間,阿爾茨海默病報告的死亡人數(shù)增加了140%以上。然而,目前還沒有行之有效的方法來預(yù)防阿爾茨海默病,也沒有治愈的方法。
典型的AD病理特征包括廣泛分布于大腦皮層的由β-淀粉樣蛋白(Aβ)聚集形成的細胞外淀粉樣斑塊,以及Tau蛋白過度磷酸化和聚集形成的細胞內(nèi)神經(jīng)纖維纏結(jié)(NFTs)。阿爾茨海默病的確切發(fā)病機制尚不清楚,患者大腦中細胞外淀粉樣斑塊和細胞內(nèi)NFTs的存在已被證明在疾病的發(fā)病機制中發(fā)揮關(guān)鍵作用。
針對AD的一些已知的病理因素,包括Aβ聚集、Tau蛋白聚集、神經(jīng)炎癥反應(yīng)、氧化應(yīng)激、線粒體功能障礙、膽堿能神經(jīng)元損傷、金屬粒子穩(wěn)態(tài)失衡等,被認為是AD的主要病理機制。
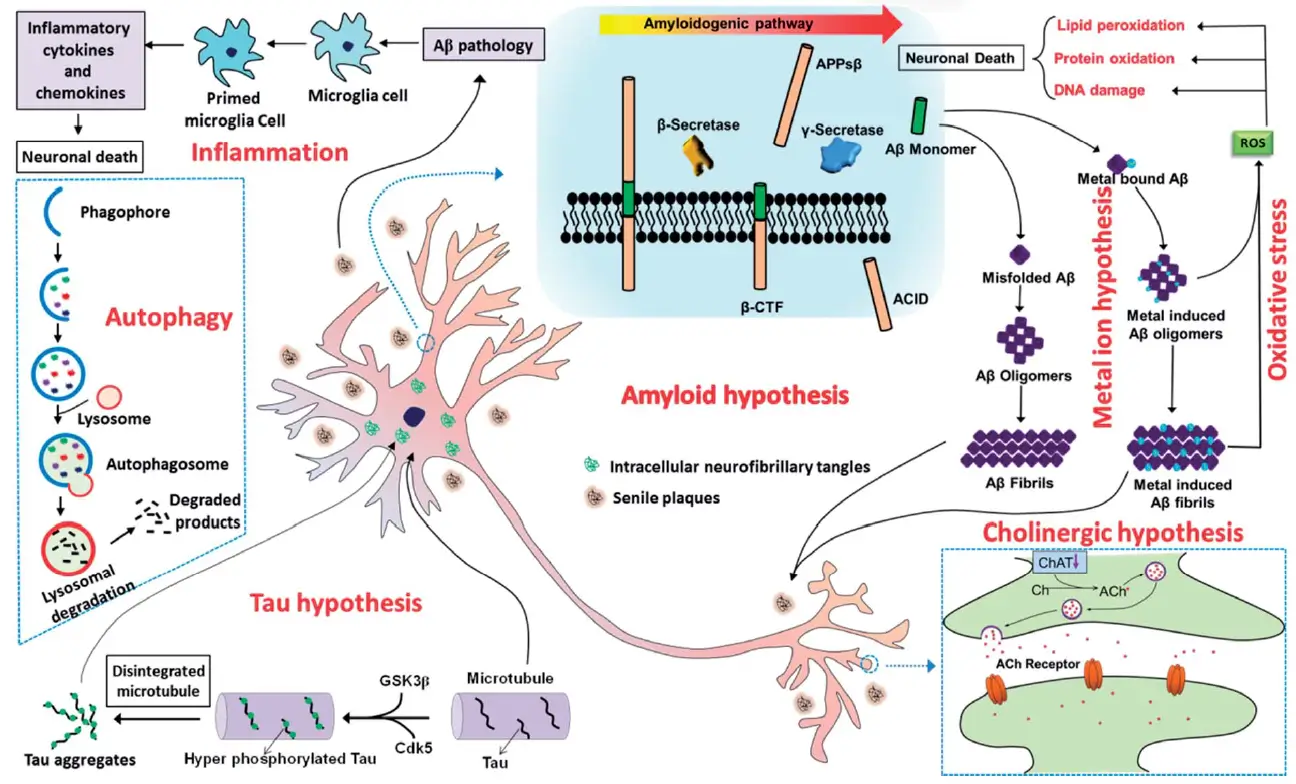
阿爾茨海默病的多種病理機制[2]
由于AD的發(fā)病機制復(fù)雜,各機制間相互關(guān)聯(lián)和相互影響,為抗AD藥物開發(fā)的多靶點策略提供了良好的理論基礎(chǔ)。
多靶點配體(Multi-target-directed ligands, MTDL)設(shè)計策略是利用具有兩種或兩種以上互補生物活性的單一化合物,對AD的復(fù)雜病理機制產(chǎn)生協(xié)同作用,從而顯著改善記憶和認知障礙。因此,目前的方法大多是基于分子雜交,將兩個或多個具有特定性質(zhì)的藥效團組合在一個分子中,從而獲得能夠有效抗AD的多靶點活性化合物。
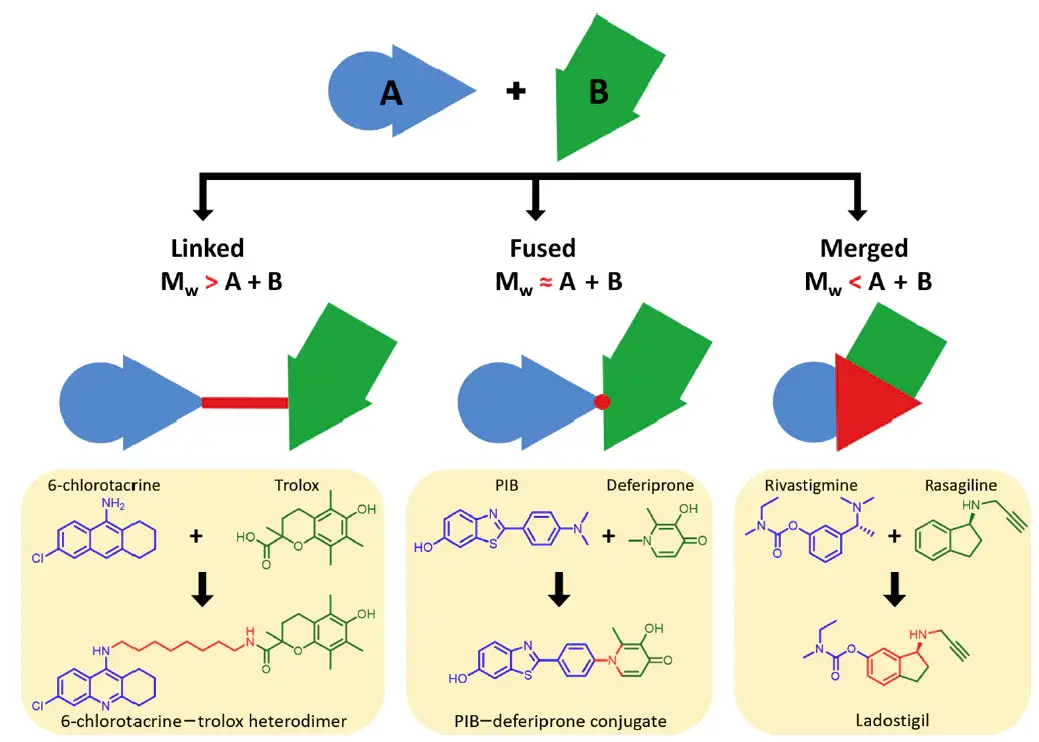
設(shè)計多靶點配體(MTDL)分子的三種可用的策略示意圖[3]
MTDL分子作用于兩種或兩種以上與疾病相關(guān)的靶點,然而,由幾種單靶點藥物組成的聯(lián)合治療也可以達到類似的治療效果。在理想情況下,MTDL方法要優(yōu)于聯(lián)合治療,因為它即保留了聯(lián)合治療的所有好處,并增加了一些額外的益處。
例如, MTDL作為單一化合物,應(yīng)該沒有藥物-藥物相互作用的風(fēng)險,且與其他藥物相互作用的風(fēng)險也較低。此外,越多的藥物組合,發(fā)生不良反應(yīng)的可能性越高,MTDL分子不良反應(yīng)的風(fēng)險也會降低。
另一個優(yōu)點是,MTDL方法是簡化了給藥方案,從而提高了患者依從性。在某些情況下,聯(lián)合治療也可以通過在一種藥物制劑中使用幾種單靶點藥物的固定劑量組合,來解決這一問題。然而,這種藥物組合受到每種成分不同藥代動力學(xué)的影響,在給藥時需要尤其注意。
最后,盡管FDA通過發(fā)布藥物聯(lián)合開發(fā)指南來支持藥物聯(lián)合治療臨床試驗,但與聯(lián)合治療相比,MTDL分子的開發(fā)需要的臨床試驗更少。
乙酰膽堿酯酶(AChE)是阿爾茨海默病治療的經(jīng)典靶點。膽堿能假說認為,海馬體和新皮質(zhì)區(qū)的神經(jīng)遞質(zhì)乙酰膽堿(ACh)在學(xué)習(xí)和記憶中起著關(guān)鍵作用,膽堿能神經(jīng)元的破壞或丟失,引起乙酰膽堿水平的顯著下降是阿爾茨海默病患者認知障礙的主要原因。
在生理條件下,AChE能高效地將乙酰膽堿水解成膽堿和乙酸根離子。因此,抑制AChE能夠有效提高突觸間隙乙酰膽堿濃度,使其成為膽堿能系統(tǒng)的重要靶點。
FDA批準(zhǔn)了多種AChE抑制劑(AChEIs)用于治療AD,證明了AChE抑制劑的治療價值,包括多奈哌齊、加蘭他敏、利斯的明、他克林、石杉堿甲(中國批準(zhǔn))。
此外,AChE在AD的發(fā)展中還具有非膽堿能功能。研究發(fā)現(xiàn),AChE外周陰離子位點(PAS)能催化Aβ聚集,特別是Aβ1-42的聚集導(dǎo)致大腦中老年斑的形成,且與神經(jīng)變性有關(guān)。適當(dāng)?shù)腁ChEIs可以抑制AChE誘導(dǎo)的Aβ的聚集和纖維化,表明AChEIs在抗AD治療中具有多功能作用。
在誘發(fā)AD的多種病因中,Aβ沉積和Tau蛋白過度磷酸化已被廣泛接受。Tau蛋白假說認為,微管解聚和神經(jīng)纖維纏結(jié)的產(chǎn)生,主要是由Tau蛋白過度磷酸化引起的,加速了神經(jīng)元細胞的變性和壞死,導(dǎo)致疾病的進行性惡化。
糖原合酶激酶-3β(GSK-3β)催化的Tau蛋白過度磷酸化,主要發(fā)生在Ser-396、Ser-199和Ser-404位點,增加了額外的2-7個磷酸基團的數(shù)量,并減弱了Tau蛋白與微管的粘附作用。隨后,過度磷酸化的Tau蛋白與微管分離,聚集成不溶性的神經(jīng)纖維纏結(jié),導(dǎo)致微管結(jié)構(gòu)不穩(wěn)定,最終導(dǎo)致細胞死亡。因此,抑制Tau蛋白信號通路上游的GSK-3β能夠穩(wěn)定微管系統(tǒng),減少細胞內(nèi)神經(jīng)纖維纏結(jié)的形成。
另外,GSK-3β通過提高β-分泌酶(BACE1)的活性來促進Aβ的產(chǎn)生,Aβ沉積并最終導(dǎo)致老年斑的形成,抑制GSK-3β可通過減少Aβ的形成而輻射到Aβ信號通路。
鑒于GSK-3β在AD復(fù)雜病理中的重要作用,抑制GSK-3β可能是一種有效的抗AD策略。
該研究報道了一類AChE/GSK-3β雙重抑制劑,通過融合AChE抑制劑他克林和嘧啶酮類GSK-3β抑制劑的關(guān)鍵骨架,雜交兩類化合物結(jié)構(gòu)設(shè)計而成。
如下圖所示:該類化合物保留了他克林結(jié)構(gòu),主要用于保留AChE抑制作用;另外保留了芳香族環(huán)取代嘧啶酮的結(jié)構(gòu),用于維持潛在的GSK-3β抑制作用(嘧啶酮結(jié)構(gòu)是該類化合物發(fā)揮GSK-3β抑制作用的關(guān)鍵藥效團);中間采用烷基胺linker來橋接上述兩種藥效團。基于多靶點抗AD策略,該類化合物旨在緩解膽堿能缺陷,協(xié)同消除細胞內(nèi)神經(jīng)纖維纏結(jié)。
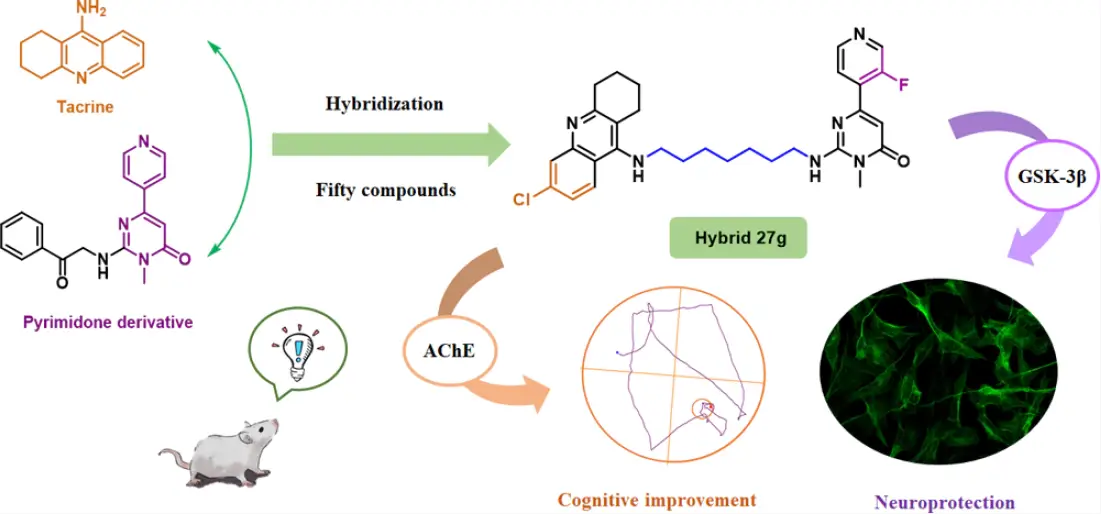
具有AChE/GSK-3β雙重抑制作用的他克林-嘧啶類化合物的設(shè)計[4]
融合他克林和嘧啶酮的新型骨架化合物,經(jīng)過結(jié)構(gòu)優(yōu)化以維持和增強靶點結(jié)合作用,包括他克林部分的取代基團優(yōu)化,以及對烷基胺linker和嘧啶片段進行修飾。
通過兩次迭代優(yōu)化,并進行了大量的藥理實驗來研究它們的類藥性質(zhì),得到了對AChE和GSK-3β同時具有良好的抑制活性的最優(yōu)化合物27g(IC50 = 51.1 nM for AChE; IC50 = 89.3 nM for GSK-3β)。
? SH-SY5Y神經(jīng)元細胞暴露于糖酵解抑制劑甘油醛(GA),導(dǎo)致糖酵解抑制、細胞凋亡和Tau蛋白磷酸化增加。在SH-SY5Y細胞中,化合物27g能夠劑量依賴性地抑制GA誘導(dǎo)的Tau蛋白S199和S396位點的磷酸化,其在較低濃度(10 nM)下對p-Tau有明顯的抑制作用,在較高濃度(0.5 μM和5 μM)下對p-Tau的改善效果與空白對照組接近。
? 對于GA誘導(dǎo)的不良反應(yīng),通過細胞活力測定和形態(tài)學(xué)研究,證實了化合物27g對SH-SY5Y神經(jīng)元細胞有明顯的神經(jīng)保護作用。
? 采用東莨菪堿誘導(dǎo)的認知受損ICR小鼠模型,使用Morris水迷宮(MWM)試驗來評價化合物改善小鼠認知障礙的體內(nèi)療效。空白對照組認知行為表現(xiàn)最佳(逃避潛伏期、搜索距離和到達次數(shù)分別為9.40 s、2.07 m、n = 6.79),東莨菪堿組認知能力表現(xiàn)相對較差(分別為23.81 s、5.00 m、n = 3.63),化合物27g(15 mg/kg/day)處理的樣品組能夠顯著改善東莨菪堿引起的認知和記憶損傷(分別為11.86 s, 2.46 m, n = 6.44),且在相同給藥劑量下與陽性對照他克林的療效相當(dāng),表明27g作為AChE抑制劑可增強膽堿能信號通路。
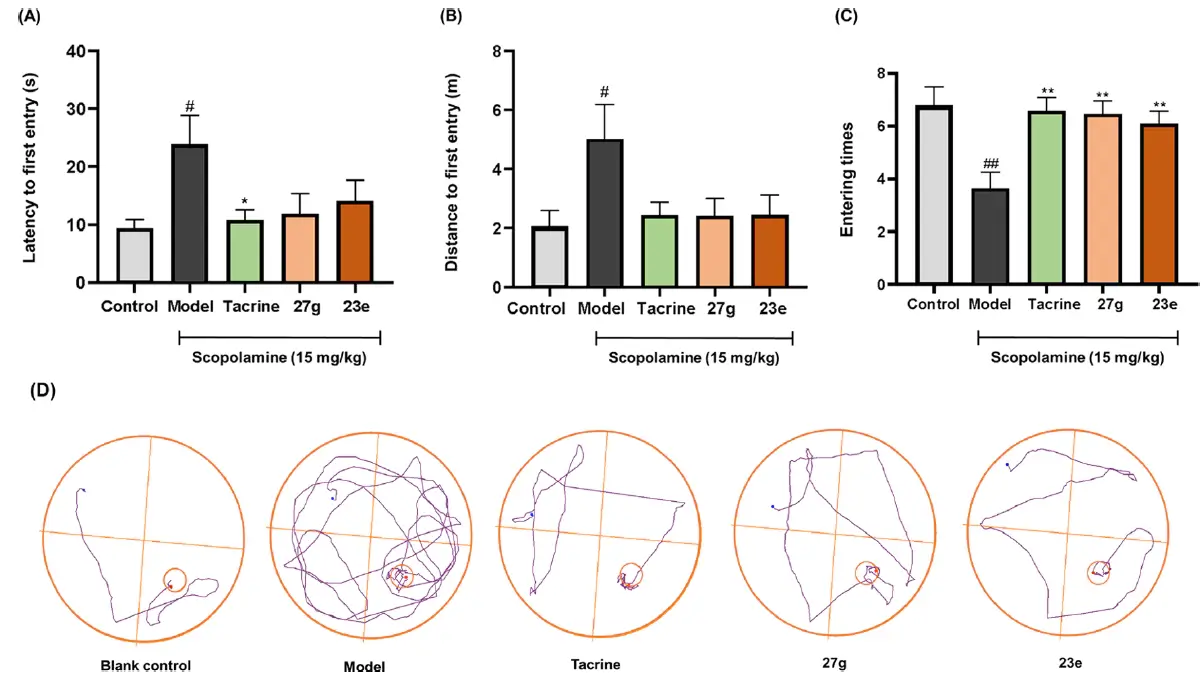
Morris水迷宮實驗評價化合物對東莨菪堿誘導(dǎo)的ICR小鼠認知功能障礙的影響[4]
雖然已批準(zhǔn)的AChE抑制劑在阿爾茨海默病的早期階段減緩了癥狀的惡化,但臨床研究表明,批準(zhǔn)的藥物在阿爾茨海默病的后期缺乏藥理作用和療效。
研究發(fā)現(xiàn),在AD患者死后腦切片中發(fā)現(xiàn)AChE活性大量降低,而丁酰膽堿酯酶(BChE)活性大量升高。在生理條件下, AChE在肌肉和神經(jīng)系統(tǒng)中占主導(dǎo)地位,并伴有較低水平的BChE。
然而,BChE的代償性作用在病理條件下是非常明顯的。在AChE敲除小鼠模型中,由于AChE缺乏,BChE被證明可以補償ACh水解,從而維持正常的膽堿能通路。在晚期AD患者中,腦內(nèi)乙酰膽堿酯酶水平急劇下降90%,而BChE則上升至正常水平的165%,接替乙酰膽堿酯酶的水解功能。因此,BChE是治療晚期AD治療的潛在靶點。
除了膽堿能功能外,BChE已被證明與Aβ高度相關(guān)。組織化學(xué)定位研究表明BChE沉積與老年斑中進行性Aβ聚集密切相關(guān)。
此外,在BChE敲除小鼠模型中,大腦中的Aβ纖維顯著減少,表明BChE可能促進Aβ沉積。研究發(fā)現(xiàn),注射神經(jīng)毒性Aβ25-35后,BChE基因敲除小鼠的認知能力不受影響,而野生型小鼠在給藥后出現(xiàn)認知損傷。因此,BChE抑制可能是清除Aβ的有效策略。
組蛋白去乙酰化酶(HDACs)通過調(diào)節(jié)組蛋白和一些非組蛋白的乙酰化狀態(tài)來調(diào)控基因表達。盡管HDACs已被證明是治療癌癥的有效靶點,但近年來,抑制HDAC在治療神經(jīng)退行性疾病方面也引起了極大的關(guān)注。其中,HDAC6是哺乳動物細胞中主要的細胞質(zhì)去乙酰化酶,其胞質(zhì)定位使得HDAC6更傾向于靶向非組蛋白,在神經(jīng)退行性疾病中得到了較為廣泛的研究。
AD患者神經(jīng)原纖維纏結(jié)(NFTs)的形成與Tau蛋白的過度磷酸化高度相關(guān),而Tau蛋白的過度磷酸化受HDAC6調(diào)節(jié)。HDAC6在AD患者大腦皮層和海馬體中的過度表達破壞了微管蛋白的轉(zhuǎn)錄后調(diào)控,微管蛋白是微管的組成部分,也是軸突運輸?shù)年P(guān)鍵組成部分。HDAC6抑制劑可以提高α-微管蛋白的乙酰化水平,從而促進Aβ和磷酸化Tau的清除,改善認知。
該研究報道了一種BChE和HDAC6的雙重抑制劑,具有減少Tau過度磷酸化和改善認知障礙的協(xié)同作用,從而改善疾病和減輕癥狀。
如下圖所示,基于該研究者之前發(fā)現(xiàn)的BChE抑制劑S11-1014,通過融合BChE抑制劑和典型的HDAC6抑制劑核心藥效團結(jié)構(gòu),開發(fā)了一系列新型的N-芐基苯甲酰胺類衍生物,作為有效的BChE/HDAC6雙重抑制劑。通過構(gòu)效關(guān)系(SAR)研究,發(fā)現(xiàn)了兩種化合物(化合物24g和29a)對BChE(hBChE IC50分別為4.0和1.8 nM)和HDAC6(IC50分別為8.9和71.0 nM)具有較好的抑制活性。
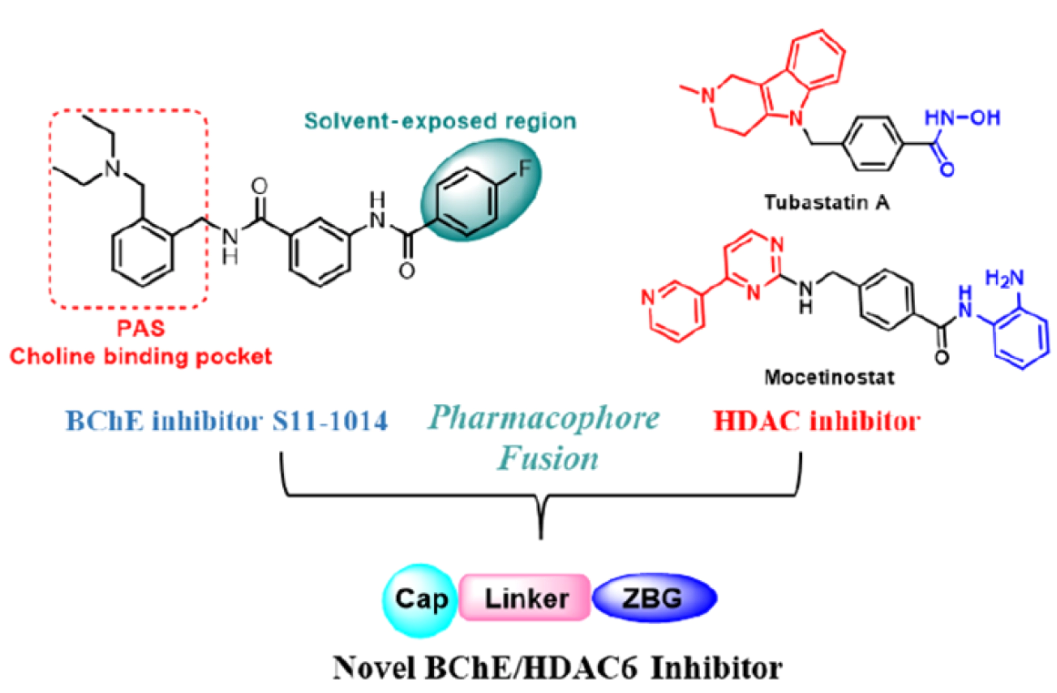
N-芐基苯甲酰胺類BChE/HDAC6雙重抑制劑的設(shè)計[5]
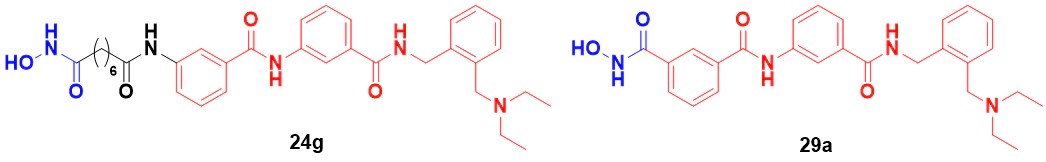
化合物24g和29a的結(jié)構(gòu)式[5]
化合物24g和29a對代表性HDAC亞型的選擇性進行了評估,這兩種化合物都可以高選擇性地抑制HDAC6。
? Western blot結(jié)果顯示,化合物24g和29a均能濃度依賴性地提高乙酰化α-微管蛋白水平,且表現(xiàn)出對磷酸化Tau蛋白的明顯抑制和適度的免疫調(diào)節(jié)作用。
? 細胞水平實驗證明化合物24g和29a毒性低,能有效保護谷氨酸和過氧化氫誘導(dǎo)的細胞損傷,具有明顯的神經(jīng)保護作用,及減少活性氧(ROS)的釋放。
? 體內(nèi)研究表明,化合物24g和29a在低劑量(2.5 mg/kg)下對Aβ1-42誘導(dǎo)的AD模型小鼠表現(xiàn)出明顯的認知改善作用。通過Morris水迷宮和Y迷宮測試,如下圖A、B所示,對照組和假手術(shù)組在到達平臺的潛伏期、運動軌跡和交替表現(xiàn)上均無顯著差異。然而,模型組小鼠軌跡混亂,目標(biāo)潛伏期不明顯,交替表現(xiàn)較弱。
在Morris水迷宮實驗中,化合物24g和29a處理的小鼠軌跡更簡潔,尋找平臺的時間更短,兩種化合物的有效性與陽性對照(ChE抑制劑rivastigmine)相當(dāng),優(yōu)于HDAC抑制劑陽性對照(SAHA和TubA)。
在Y迷宮測試中,從下圖C可以看出,24g和29a組與模型組相比,小鼠自發(fā)交替的能力有所提高(分別為75.59%和77.82%,模型組為47.19%),且略好于3個陽性藥物組。
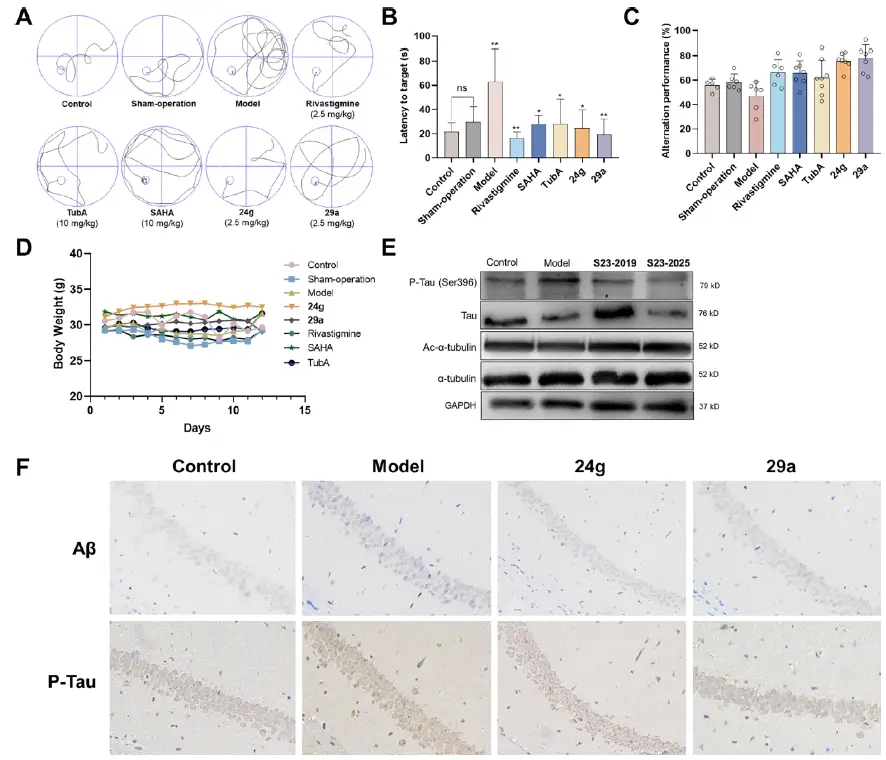
化合物24g和29a對Aβ1-42誘導(dǎo)的AD模型小鼠認知缺陷的影響[5]
美迪西能夠為阿爾茨海默病治療藥物的開發(fā)提供多種體內(nèi)外活性研究服務(wù),已建立多種靶點體外生化活性檢測、細胞水平活性檢測、以及動物體內(nèi)藥效模型等服務(wù)。
如:乙酰膽堿酯酶(AChE)、單胺氧化酶(MAO)、糖原合酶激酶-3β (GSK-3β)、組蛋白去乙酰化酶(HDACs)、磷酸二酯酶(PDEs)等等。
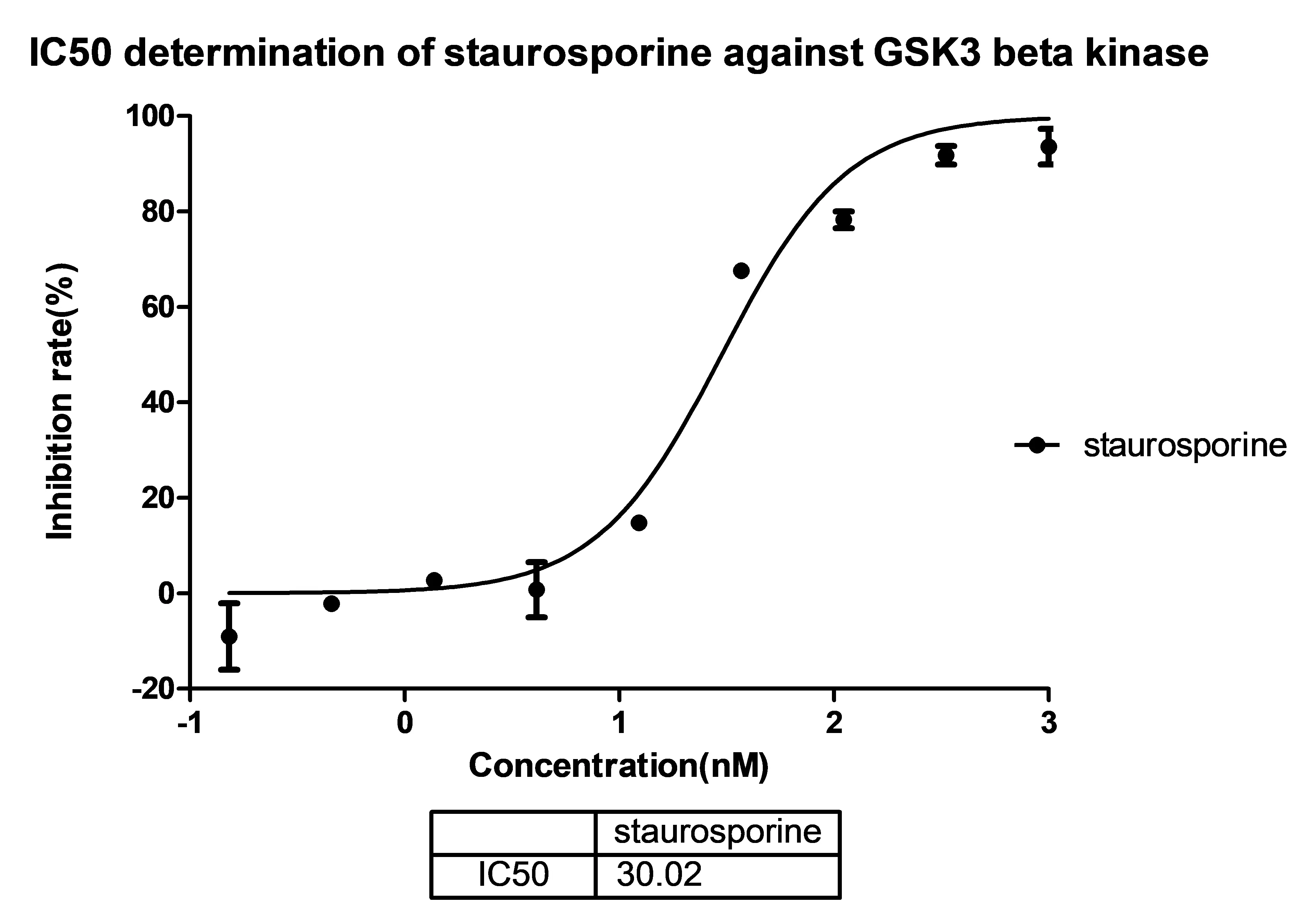
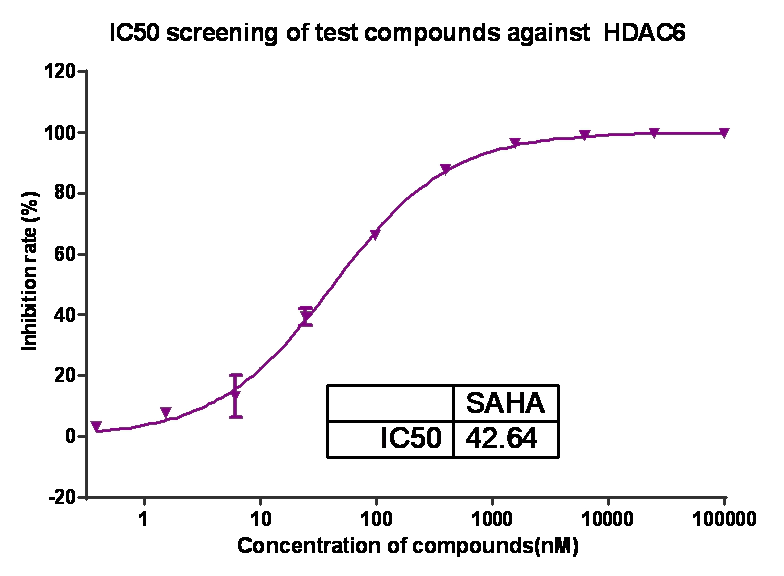
如:乙酰膽堿酯酶(AChE)、單胺氧化酶(MAO)、糖原合酶激酶-3β (GSK-3β)、組蛋白去乙酰化酶(HDACs)、磷酸二酯酶(PDEs)等等

更多檢測 請聯(lián)系美迪西詳詢
美迪西藥效平臺擁有豐富的AD項目經(jīng)驗。我們根據(jù)供試品作用機制選擇合適的動物模型;運用經(jīng)典的Morris水迷宮測試,并結(jié)合先進的CognitionWall測試,進而更詳細地分析與認知和記憶相關(guān)的行為變化;此外,通過病理和分子細胞學(xué)測試結(jié)果的綜合評估,全面評價抗AD藥物的臨床前療效。

[1] Alzheimer’s Association. 2024 Alzheimer’s disease facts and figures. Alzheimer’s Dement. 2024, 20: 3708–3821.
[2] K Rajasekhar, et al. Current progress, challenges and future prospects of diagnostic and therapeutic interventions in Alzheimer's disease. RSC Adv. 2018, 8(42): 23780-23804.
[3] Ondrej Benek, et al. A Perspective on Multi-target Drugs for Alzheimer's Disease. Trends Pharmacol. Sci. 2020, 41(7): 434-445.
[4] Hong Yao, et al. Discovery of Novel Tacrine-Pyrimidone Hybrids as Potent Dual AChE/GSK-3 Inhibitors for the Treatment of Alzheimer's Disease. J. Med. Chem. 2021, 64(11): 7483-7506.
[5] Lei Wang, et al. Design, Synthesis, and Proof of Concept of Balanced Dual Inhibitors of Butyrylcholinesterase (BChE) and Histone Deacetylase 6 (HDAC6) for the Treatment of Alzheimer's Disease. ACS Chem. Neurosci. 2023, 14(17): 3226-3248.
 相關(guān)新聞
相關(guān)新聞