



業(yè)務(wù)咨詢
中國:
Email: marketing@medicilon.com.cn
業(yè)務(wù)咨詢專線:400-780-8018
(僅限服務(wù)咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




美迪西“仿制藥質(zhì)量一致性評價”服務(wù)介紹![]()
“仿制藥質(zhì)量一致性評價”主要針對2007年新版《藥品注冊管理辦法》頒布實施之前批準的口服仿制藥,主要包括片劑、膠囊劑和顆粒劑等,進行質(zhì)量再評價。評價要求考察國內(nèi)企業(yè)生產(chǎn)的產(chǎn)品與原研產(chǎn)品在溶出度和有關(guān)物質(zhì)等關(guān)鍵質(zhì)量指標上是否一致。如果質(zhì)量不一致,則要求企業(yè)對產(chǎn)品進行處方工藝改進。
考慮到國內(nèi)仿制藥質(zhì)量大多數(shù)達不到原研產(chǎn)品的水平,因此“質(zhì)量一致性評價”的具體業(yè)務(wù)一般包括兩個部分:
1.對企業(yè)產(chǎn)品的溶出度和有關(guān)物質(zhì)與參比制劑進行對比,根據(jù)研究數(shù)據(jù)判斷兩者質(zhì)量是否一致。
2.如果質(zhì)量不一致,則需要按照仿制藥研發(fā)的要求,對該產(chǎn)品的處方工藝進行重新開發(fā),將開發(fā)好的新處方工藝移交給企業(yè)并且支持企業(yè)進行申報。
仿制藥:是指與原研藥在安全性、有效性、劑量、質(zhì)量作用與適應(yīng)癥相同的一種仿制品。
仿制藥與創(chuàng)新藥的一致性主要研究內(nèi)容:
1、生物等效性——體內(nèi)bloodstream;相同的時間,相同的物質(zhì),相同的量
2、臨床一致性
3、質(zhì)量體系=產(chǎn)品一致性
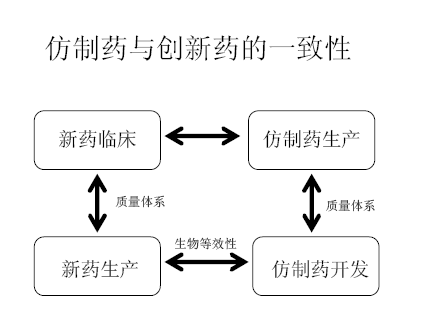
仿制藥和創(chuàng)新藥的一致性
仿制藥質(zhì)量一致性評價
主要步驟:①體外溶出實驗——藥品檢測機構(gòu)
②生物等效性——生產(chǎn)企業(yè)
質(zhì)量一致性評價的含義
涵義——狹義:符合相同的質(zhì)量標準
涵義——廣義:相同的活性成份、適應(yīng)癥、劑型、規(guī)格、給藥途徑;符合相同的質(zhì)量標準、生物等效
注射劑——安全性:有關(guān)物質(zhì)、熱源、細菌內(nèi)毒素、無菌、異常毒等
口服固體制劑——安全性:有關(guān)物質(zhì)
——有效性:生物等效性
受試制劑與參比制劑溶出或釋放曲線一致時,生物等效的可能性大大增加——關(guān)鍵
藥物溶出度試驗是考察、評價制劑內(nèi)在質(zhì)量的重要指標。是考察在生產(chǎn)工藝、制劑配方的重要手段。并作為藥物體外-體內(nèi)相關(guān)(invitro-in vivo correlation,IVIVC)、生物等效性(Bioequivalance)與生物有效性(Bioavailability)的評價手段。
※固體制劑口服給藥后,藥物的吸收取決于:藥物釋放,胃腸道的生物膜通透性
※溶出度意義:
(1)、評價制劑批間質(zhì)量的一致性(2)、指導新制劑的開發(fā)
(3)、產(chǎn)品發(fā)生某些變更后,如處方、生產(chǎn)工藝、生產(chǎn)場所變更和生產(chǎn)工藝放大后,確保藥品質(zhì)量和療效的一致性
了解更多 仿制藥質(zhì)量一致性評價
聯(lián)系我們:
郵箱:marketing@medicilon.com.cn
電話:021-58591500
網(wǎng)址:www.2tiens.com
 相關(guān)新聞
相關(guān)新聞