



業務咨詢
中國:
Email: marketing@medicilon.com.cn
業務咨詢專線:400-780-8018
(僅限服務咨詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




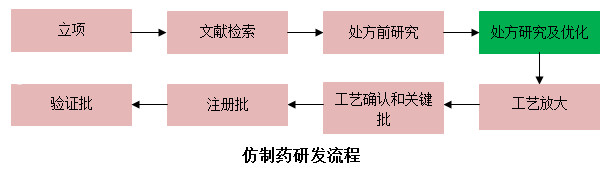
美迪西處方研究及優化服務主要解決客戶在新藥或仿制藥研發過程中遇到的生產工藝放大、生產工藝優化和研發等問題,我們擁有專業的研發團隊,提供先進的儀器設備。
美迪西是一家綜合性的生物醫藥研發服務公司,我們致力于為客戶提供快捷高效的服務。 我們特有的“定制化”制藥工藝研發模式也充分體現了這一理念,能夠讓客戶盡早得到API以便展開臨床研究。
美迪西專業的研發團隊,擁有豐富經驗和能力,利用足夠的資源、完備的生產設備及最新先進的生產設施,作為您長期的戰略伙伴,為客戶提供高效率和最大化產能的服務,節省客戶的時間和成本,為您生產可靠的、高性價比的中間體和API產品。
工藝研發部門致力于開發穩定低成本且適合大規模生產的工藝。我們的研發團隊在對工藝優化,開發新型、安全和環境友好的工藝路線有著豐富的經驗。
工藝研發項目團隊對以下的研究方向有豐富的經驗:
商業化路線的篩選
通過反應設計(DoE)和質量設計(QbD)進行商業化工藝的開發與優化
單元操作研究和各步驟關鍵工藝參數的確認
雜質的結構,來源以及控制的研究
GMP起始原料的界定
由于原料藥本身的可壓性和流動性均較差,因此劑量較小的藥物,可以忽略原料藥的可壓性和流動性而直接采用直接壓片。而對于劑量較大的藥物,可以通過濕法制粒來改善其流動性和可壓性,下表列出適合直接壓片和濕法制粒的藥物規格范圍供參考。當然具體還要根據藥物的理化性質來確定。
直接壓片 | 濕法制粒 | |||
規格 | 片重范圍 | 規格 | 片重范圍 | |
1-5 mg | 100-140 mg | 0.5-50 mg | 100-200 mg | |
6-10 mg | 200-280 mg | 100-250 mg | 300-550 mg | |
20 mg | 300 mg | 750 mg | 850-980 mg | |
直接壓片工藝關鍵在于輔料的選擇。主要考查混合均勻性,流動性和可壓性等,當然也包括其它必檢項目如含量,雜質,溶出等。
選擇合適的混合設備和批量,預混時間,制粒所需的潤濕劑用量,制粒終點的確定,水分的限度,干燥溫度的選擇,干燥時間和水分的量化關系等。顆粒的測試和片的檢測項目項目同直接壓片。
目前研發的產品大多傾向于用直接壓片的方法,其優點在于耗時短,工藝可靠性高,粉塵可控,勞動強度小。
以濕法制粒為例,處方優化需要評價項目有:
制粒混合時間,攪拌槳和切刀速度,潤濕劑的加入速率和用量,整粒目數的選擇,顆粒粒徑分布同壓片的關系。
干燥溫度范圍的選擇和水分含量的限度范圍。
顆粒中各組分的混合時間,不同混合時間對含量均勻性的影響,潤滑劑種類、用量和混合時間對溶出釋放的影響。
硬度對片的影響,如脆碎度,溶出度等。硬度范圍的選擇。
包衣設備的速度,噴漿速度,噴槍同片床的高度,進風和出風溫度控制,片床溫度控制,蠕動泵速度,包衣增重取樣檢測,包衣增重同時間的關系,包衣后片硬度的變化研究。
通過上面的優化結果,初步確定最終處方。
按照初步確定的最終處方,將實驗室所得樣品放初步穩定性研究。根據所得穩定性研究數據,初步制定產品內控質量標準。
最終綜合總結本步驟的研究,完成處方優化和確定報告,并入產品研發報告中。
生產放大,是將在試驗室階段的問題放大,并為我們及時盡早發現解決問題提供了保障,一般來講,生產放大的成功與否,基本上決定了產品在后續的生產工藝確認批,關鍵批的成敗。
由于物料的數量和設備的生產能力,尺寸的增加,在混合,制粒的過程中,攪拌槳和切刀的速度,粘合劑或潤濕劑的加入時間,制粒終點的判斷,烘箱或流化床的效率,整粒機的速度和篩網,上述各點對生產放大來講都是關鍵控制點,做好制粒工作,將為壓片做好前期工作。
壓片。在壓片研究中,速度研究要記錄壓片機的最低和最高速度,硬度研究要記錄壓片機對產品所能達到的最低和最高硬度。包衣過程中要盡量同實驗室研究包衣的條件一致,使包衣工藝有連續性。
統計總結本步驟所得數據并形成報告,并入產品研發報告中。
工藝確認批和工藝放大批應作為單獨的批次來評價。
本批的生產是為了檢查在生產過程中是否還有問題出現,允許在關鍵批生產前解決生產過程中出現的問題,其批量可以等同于放大批的批量,或70%關鍵批批量,或10%商業批的批量。
在這個階段,要充分準備生產所需的所有主文件和工藝規程,并被QA批準。
總結本步驟所得數據并形成報告,并入產品研發報告中。
本批是向官方遞交資料的基礎,因此可以說是最重要最關鍵的一批,本批將用于生物等效性研究,正式穩定性研究。因此在進行本批生產前要進行充分的準備。本批生產將涉及到研發、生產、QA、QC以及注冊等各個部門。
在正式生產前,應對涉及的所有生產以及QA人員進行有效培訓,嚴格控制生產過程中的各個關鍵點。
總結本步驟所得數據并形成報告,并入產品研發報告中。
郵箱:marketing@medicilon.com.cn
電話:021-58591500